题目内容
11.A、B、C、D、E为原子序数依次增大的五种短周期元素,B3-、C2-、D2+具有相同的电子层结构,且比A-多1个电子层,而比E2-少8个电子,请回答下列问题:(1)元素B在周期表中的位置是第二周期VA族;
(2)元素A和C可以组成两种常见的化合物,其中一种是最常用的溶剂,该化合物的电子式为
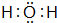 ,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;
,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;(3)写出元素B与D形成的化合物遇水时产生气体和沉淀的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,B3-、C2-、D2+具有相同的电子层结构,且比A-多1个电子层,而比E2-少8个电子,则A为H元素、B为N元素、C为O元素、D为Mg、E为S元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,B3-、C2-、D2+具有相同的电子层结构,且比A-多1个电子层,而比E2-少8个电子,则A为H元素、B为N元素、C为O元素、D为Mg、E为S元素.
(1)元素B为N元素,在周期表中的位置是:第二周期VA族,故答案为:第二周期VA族;
(2)元素A和C可以组成两种常见的化合物为H2O、H2O2,其中H2O是最常用的溶剂,其电子式为 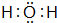 ,H2O2与S2-反应的离子方程式为:4H2O2+S2-=SO42-+4H2O,
,H2O2与S2-反应的离子方程式为:4H2O2+S2-=SO42-+4H2O,
故答案为: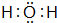 ;4H2O2+S2-=SO42-+4H2O;
;4H2O2+S2-=SO42-+4H2O;
(3)元素B与D形成的化合物为Mg3N2,遇水时发生水解反应生成氢氧化镁与氨气,反应化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
点评 本题考查结构性质位置关系应用,关键是明确元素种类,侧重对化学用语的考查,难度中等.

练习册系列答案
相关题目
2.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
| A. | 若R(OH)n为强碱,则W(OH)(n+1)也为强碱 | |
| B. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| C. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
19.化合物Y2X在水中能电离出具有相同电子层结构的阴阳离子,该化合物可能为( )
| A. | H2O | B. | Na2O | C. | KCl | D. | Na2S |
6.如果用●代表原子实(原子实是原子除去最外层电子后的剩余部分),小黑点代表未用于形成共价键的最外层电子,一条短线代表一对共用电子对.如F2或Cl2均可表示为 .图甲和图乙所表示的有机分子依次是( )
.图甲和图乙所表示的有机分子依次是( )
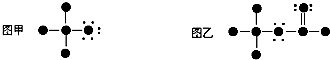
 .图甲和图乙所表示的有机分子依次是( )
.图甲和图乙所表示的有机分子依次是( )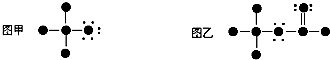
| A. | CCl3H CF3COOH | B. | CH3Cl CH3COOH | ||
| C. | CH3FHCOOCH3 | D. | CH3OH CH2OHCHO |
3.能用溶解、过滤、蒸发、结晶分离的一组混合物是( )
| A. | 酒精和水 | B. | 氯化钠和碳酸钠 | ||
| C. | 碳酸钙和二氧化锰 | D. | 碳酸钙和氯化钠 |
 下列各物质均为中学化学中常见物质,其中A、B、C是三种常见金属.E在常温下是无色液体,D是空气的主要成分之一,与I反应生成E.K的焰色反应为黄色,J是一种磁性氧化物.在适当的条件下,它们之间可以发生如下图所示的转化(部分产物被略去).
下列各物质均为中学化学中常见物质,其中A、B、C是三种常见金属.E在常温下是无色液体,D是空气的主要成分之一,与I反应生成E.K的焰色反应为黄色,J是一种磁性氧化物.在适当的条件下,它们之间可以发生如下图所示的转化(部分产物被略去).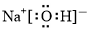 .
. 、
、 、
、 .
.