题目内容
6.如果用●代表原子实(原子实是原子除去最外层电子后的剩余部分),小黑点代表未用于形成共价键的最外层电子,一条短线代表一对共用电子对.如F2或Cl2均可表示为 .图甲和图乙所表示的有机分子依次是( )
.图甲和图乙所表示的有机分子依次是( )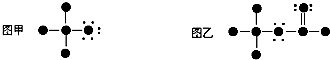
| A. | CCl3H CF3COOH | B. | CH3Cl CH3COOH | ||
| C. | CH3FHCOOCH3 | D. | CH3OH CH2OHCHO |
分析 根据原子的成键特点:H原子只能形成一条共价;,C原子能形成4条共价键;卤素原子原子形成1条共价键,还有3对孤电子对;O原子形成2条共价键,还有2对孤电子对.据此分析.
解答 解:原子的成键特点:H原子只能形成一条共价;,C原子能形成4条共价键;卤素原子原子形成1条共价键,还有3对孤电子对;O原子形成2条共价键,还有2对孤电子对,可知,甲为一卤甲烷,即CH3F或CH3Cl或CH3Br或CH3I;乙为HCOOCH3,故选C.
点评 本题考查了常见元素的成键特点,题目难度不大,注意把握原子形成的共价键数目与其原子核外的单电子数有关.

练习册系列答案
相关题目
16.下列有关化学用语的表达正确的是( )
| A. | Cl-的结构示意图: | |
| B. | Na2O2的电子式为: | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | 丙烯的结构式:CH3CHCH2 |
1.我国最早报道的超高温导体中,铊是重要组成之一.已知铊是ⅢA族元素,关于铊的性质判断正确的是( )
| A. | 铊既能与强酸反应又能与强碱反应 | B. | 能生成+3价的化合物 | ||
| C. | Tl(OH)3与Al(OH)3一样是两性氢氧化物 | D. | Tl(OH)3的碱性比Al(OH)3强 |
16.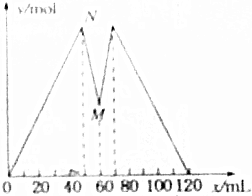 如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
 如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )| A. | N点时溶液中的溶质只有NaCl | |
| B. | 原混合溶液中c(MgCl2):c(AlCl3)=1:2 | |
| C. | c(NaOH)=c(HCl) | |
| D. | M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
 或
或 .
.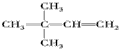 、
、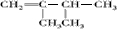 、
、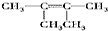 ;比烃A少2个碳原子的同系物有4种同分异构体,其中能和H2发生加成反应生成2-甲基丙烷的同分异构体的名称是2-甲基丙烯.
;比烃A少2个碳原子的同系物有4种同分异构体,其中能和H2发生加成反应生成2-甲基丙烷的同分异构体的名称是2-甲基丙烯.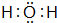 ,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;
,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;