题目内容
20.已知金属钠投人水中能发生下列反应:2Na+2H2O═2NaOH+H2↑,则把2.3g Na投人91.8g水中,才能使溶液中水分子的物质的量是Na+的50倍,同时生成标准状况下H2的体积为1.12L.分析 根据n=$\frac{m}{M}$计算钠的物质的量,根据方程式计算消耗水的物质的量、生成氢气物质的量,根据溶液中水分子的物质的量是Na+的50倍计算溶液中溶剂水的物质的量,可以计算水的总物质的量,根据m=nM计算需要水的总质量,根据V=nVm计算生成氢气的体积.
解答 解:2.3g Na的物质的量为$\frac{2.3g}{23g/mol}$=0.1mol,
2 Na+2 H2O═2NaOH+H2↑
0.1mol 0.1mol 0.05mol
溶液中水分子的物质的量是Na+的50倍,则溶液中溶剂水的物质的量为0.1mol×50=5mol,需要水的总物质的量为5mol+0.1mol=5.1mol,需要水的总质量为5.1mol×18g/mol=91.8g,
标况下生成氢气的体积为0.05mol×22.4L/mol=1.12L,
故答案为:91.8;1.12.
点评 本题考查化学方程式有关计算,难度不大,学生容易忽略反应消耗水的质量.

练习册系列答案
相关题目
10.下列反应属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | H2+CuO═Cu+H2O | ||
| C. | CaCO3═CaO+CO2↑ | D. | KOH+HNO3═KNO3+H2O |
5.下列实验操作正确的是( )
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 配制一定物质的量浓度溶液时,在溶解、移液、洗涤、定容时均要用到玻璃棒 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
12.下列装置及相应操作能达到实验目的是( )
| A. | 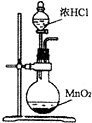 用装置制取氯气 | |
| B. | 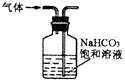 用装置除去CO2中的少量SO2气体 | |
| C. | 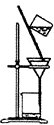 用装置分离回收H2 02制氧气中的二氧化锰 | |
| D. | 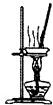 用装置将MgCl2.6H2O加热得到MgCl2 |
16.下列说法错误的是( )
| A. | 高铁酸钠是一种优良的净水剂 | |
| B. | 锅炉用水的软化可以用阳离子交换法 | |
| C. | 聚氯乙烯塑料薄膜可用于制食品包装袋 | |
| D. | 若镀层被破坏镀锡的铁皮不如镀锌的铁皮耐腐蚀 |
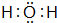 ,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;
,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;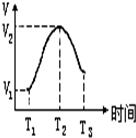 把锌片投入到盛有稀硫酸的试管中,发现产生氢气的速率变化如图所示,其中T1~T2速率变化的主要原因是:镁条与酸的反应是放热反应,溶液温度升高,反应速率加快,T2~T3速率变化的主要原因是硫酸浓度减小,反应速率减慢.
把锌片投入到盛有稀硫酸的试管中,发现产生氢气的速率变化如图所示,其中T1~T2速率变化的主要原因是:镁条与酸的反应是放热反应,溶液温度升高,反应速率加快,T2~T3速率变化的主要原因是硫酸浓度减小,反应速率减慢.