题目内容
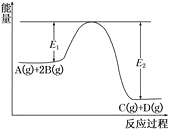
【题目】(1)2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH= 99 kJ/mol。

请回答下列问题:
①图中A点表示:__________________________。
C点表示:______________________________。
E的大小对该反应的反应热______(填“有”或“无”)影响。
②25℃、101 kPa下测得,2mol SO2和1 mol O2充分反应放出热量________198 kJ(填“大于”、“等于”或“小于”)。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:_____________________________。
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g)+![]() O2(g)
O2(g)![]() H2O( l )的ΔH =________________kJ/mol。
H2O( l )的ΔH =________________kJ/mol。
【答案】 反应物的总能量 生成物的总能量 无 小于 H2 ( g ) +![]() O2 ( g )
O2 ( g )![]() H2O ( g ) ΔH =241.8 kJ/mol(或2H2 (g) +O2(g)
H2O ( g ) ΔH =241.8 kJ/mol(或2H2 (g) +O2(g)![]() 2H2O(g) ΔH =483.6 kJ/mol) 286.8
2H2O(g) ΔH =483.6 kJ/mol) 286.8
【解析】(1)①图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,加入催化剂,活化能减小,反应反应热不变,活化能的大小与反应热无关。②25℃、101 kPa下测得,2mol SO2和1 mol O2充分反应达到平衡后,转化率不可能达到100%,放出热量小于198 kJ;(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得),该反应的热化学方程式为:H2 ( g ) +![]() O2 ( g )
O2 ( g )![]() H2O ( g ) ΔH =241.8 kJ/mol(或2H2 (g) +O2(g)
H2O ( g ) ΔH =241.8 kJ/mol(或2H2 (g) +O2(g)![]() 2H2O(g) ΔH =483.6 kJ/mol) ;②若1mol水蒸气转化为液态水放热45kJ,即H2O(g)=H2O(l)△H=-45kJ·mol-1,A.H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJ·mol-1,B.H2O(g)=H2O(l)△H=-45kJ·mol-1,A+B得:H2(g)+1/2O2(g)═H2O(l)△H=-286.8kJ·mol-1,1mol氢气完全燃烧生成液态水所放出的热量为其燃烧热,所以其燃烧热为-286.8kJ·mol-1。
2H2O(g) ΔH =483.6 kJ/mol) ;②若1mol水蒸气转化为液态水放热45kJ,即H2O(g)=H2O(l)△H=-45kJ·mol-1,A.H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJ·mol-1,B.H2O(g)=H2O(l)△H=-45kJ·mol-1,A+B得:H2(g)+1/2O2(g)═H2O(l)△H=-286.8kJ·mol-1,1mol氢气完全燃烧生成液态水所放出的热量为其燃烧热,所以其燃烧热为-286.8kJ·mol-1。

【题目】I、在下列物质转化中A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答:
(1)A的化学式是______, Z的电子式是______。
(2)当X是强酸时,写出C→D的化学方程式:_____。
(3)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:_____。
II、在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (其相对分子质量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(4)为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是____(填字母代号)。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(5)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
①上表中第一次实验中记录数据明显大于后两次,其原因可能是_____(填字母代号)。
A.滴定前滴定管尖嘴无气泡,滴定结束有气泡
B.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
D.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
②通过实验数据计算的该产品纯度为_____(用字母a、c表示)。
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为: 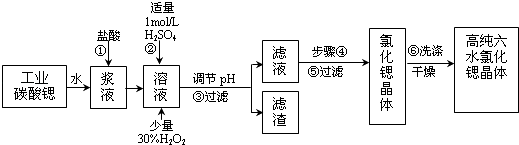
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl26H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①中碳酸锶与盐酸反应的离子方程式 .
(2)在步骤②﹣③的过程中,将溶液的pH值由1调节至;宜用的试剂为 . A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是 .
(4)操作③中所得滤渣的主要成分是(填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是 .
A.50~60℃
B.80~100℃
C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是 .