题目内容
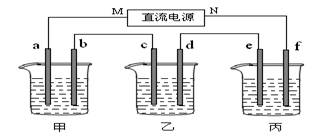
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为___________极;
②电极b上发生的电极反应为______________________________;
③列式计算电极b上生成的气体在标准状况下的体积:______________________________;
④电极c的质量变化是__________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液______________________________;
乙溶液______________________________;
丙溶液______________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
____________________________________________________________。
(1)①正 ②4OH--4e-====O2↑+2H2O ③设丙中电解H2O质量为x
100 g×10.00%=(100 g-x)·10.47%
解得x=4.5 g,
![]()
由关系式2H2O→O2↑
得b上气体体积为
V(O2)=0.25 mol×![]() ×22.4 L·mol-1=2.8 L
×22.4 L·mol-1=2.8 L
④16
⑤见解析
(2)见解析
解析:本题考查电化学——电解池原理相关知识。图中给出三个串联的电解池,电解质溶液互不相同,因而电解过程及结果都不同,但它们有一个联系点,就是导线上通过的电子相等,即电子守恒。这是解该类计算题的基本依据。本题的突破口之一在于发现丙中K2SO4浓度前后变化情况——浓度由10.00%变为10.47%,结合阴、阳离子放电顺序可知,丙中实质是电解水。经过简单计算:100×10.00%=(100-x)×10.47%,可知x=4.5 g,即n(H2O)=0.25 mol,据2H2O![]() 2H2+O2可知0.25 mol水放电转移电子数为0.5 mol,由此求得③④两问。另一突破口即是:乙中C电极质量增加。说明C为阴极,析出铜。由此推知各电极名称及电源M、N的名称。进而判断书写各电极反应式及产物。相关计算:③问:b极析出O2:
2H2+O2可知0.25 mol水放电转移电子数为0.5 mol,由此求得③④两问。另一突破口即是:乙中C电极质量增加。说明C为阴极,析出铜。由此推知各电极名称及电源M、N的名称。进而判断书写各电极反应式及产物。相关计算:③问:b极析出O2:![]() 。④问:C极析出铜质量为:
。④问:C极析出铜质量为:![]() 。⑤问:甲为NaOH溶液,属电解H2O型,故c(NaOH)变大,pH增大;乙为CuSO4溶液,属“放氧生酸”型,故pH减小;丙是K2SO4溶液,属电解水型,原本是中性,故pH不变。
。⑤问:甲为NaOH溶液,属电解H2O型,故c(NaOH)变大,pH增大;乙为CuSO4溶液,属“放氧生酸”型,故pH减小;丙是K2SO4溶液,属电解水型,原本是中性,故pH不变。
(2)若Cu全部析出,溶液为稀硫酸,电解仍然继续进行。

 阅读快车系列答案
阅读快车系列答案(12分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42—、OH- |


接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)写出乙烧杯的电解池反应
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。