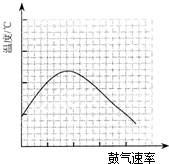
题目内容
某化学小组用下列装置抽取收集纯净的氯气,并研究其性质.请回稳下列问题.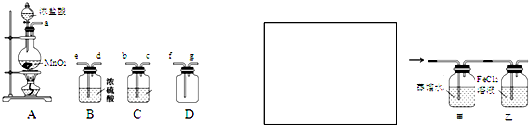
(1)装置A中发生反应的离子方程式为
(2)按照气流方向各仪器接口的连接顺序为a→
(3)装置B中浓硫酸的作用是
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂.
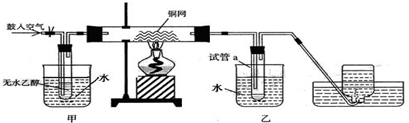
(5)装制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是
| ||
(2)要制备收集纯净的氯气应该除去氯气中的杂质(水、HCl),除氯化氢用饱和食盐水,用装置C,除去水用装置B,试剂用浓硫酸,然后收集,据此解答;
(3)从A装置中出来的氯气中含有杂质(水和氯化氢),分别用B、C装置除去;
(4)氯气有毒不能直接排放,易污染空气;
(5)氯气溶于水,发生反应生成盐酸和次氯酸,次氯酸电离得到次氯酸根离子;FeCl2溶液与Cl2发生了反应产物为氯化铁,用硫氰酸钾检验三价铁离子的存在.
| ||
故答案为:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(2)从A出来的气体含有氯化氢和水蒸气,依次通过C、D,氯气密度比空气密度大,用向上排气法收集(长进短出),所以按照气流方向各仪器接口的连接顺序为a→b→c→e→d→f→g,故答案为:bcedf;
(3)浓硫酸具有吸水性,装置B中浓硫酸的作用干燥氯气;氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以装置C中可以盛放饱和食盐水除去氯气中的氯化氢,故答案为:干燥氯气;饱和食盐水;
(4)用盛氢氧化钠溶液的烧杯吸收过量的氯气防止污染空气,故答案为:
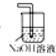 ;
;(5)氯气和水反应:Cl2+H2O=HClO+HCl,HClO电离产生含氯的氧化性离子:ClO-;氯气与氯化亚铁反应:2FeCl2+Cl2=2FeCl3,Fe3+遇硫氰酸钾显红色,所以可以选用硫氰酸钾检验三价铁离子的存在,故答案为:KSCN溶液;溶液变红色.

某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回稳下列问题。
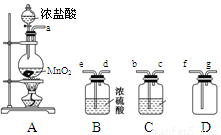
(1)装置A中发生反应的离子方程式为_______________________________。
(2)按照气流方向各仪器接口的连接顺序为a→___________________→g。
(3)装置B中浓硫酸的作用是____________________________________________________________,装置C的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
|
|
(5)装制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是_______;如何证明乙装置中FeCl2溶液与Cl2发生了反应?(只回答需要的试剂和现象)___________________________。

某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回稳下列问题。

(1)装置A中发生反应的离子方程式为_______________________________。
(2)按照气流方向各仪器接口的连接顺序为a→___________________→g。
(3)装置B中浓硫酸的作用是__________________________,装置C的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
|
|
(5)装制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是_______;如何证明乙装置中FeCl2溶液与Cl2发生了反应?(只回答需要的试剂和现象)_ 。