题目内容
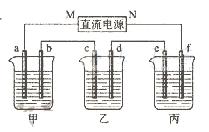
(14分)下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题:

(1)电源的N端为 极;
(2)电极b上发生的电极反应为 ;
(3)电极c上生成的气体在标准状态下的体积: ;
(4)甲溶液的氢氧根离子浓度为 (设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为 ,e电极的材料是: ,f电极的电极反应式为 。
【答案】
(14分)(1)负极
(2)2H+ + 2e- H2↑
H2↑
(3)0.112L (4)0.1 mol·L—1
(5)硫酸铜溶液(含铜离子的溶液 ) 铜棒 Cu2+ + 2e- Cu
(每空2分)
Cu
(每空2分)
【解析】略

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
(12分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42—、OH- |
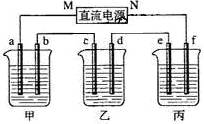
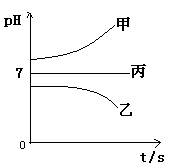
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 ;
(2)计算电极e上生成的气体在标准状态下的体积: ;
(3)写出乙烧杯的电解池反应
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。