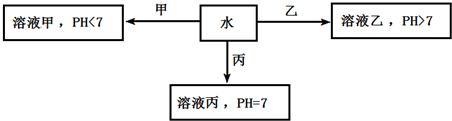
题目内容
13.向水中加入等物质的量Ag+、Na+、Pb2+、Cl-、SO42-、NO3-,用惰性电极电解所得溶液,一段时间后氧化产物与还原产物物质的量之比为( )| A. | 8:1 | B. | 2:1 | C. | 1:1 | D. | 1:2 |
分析 在纯水中加入物质的量相等的Ag+、Na+、Pb2+、Cl-、SO42-、NO3-,Ag+、Cl-反应生成AgCl沉淀,Pb2+和SO42-生成PbSO4沉淀,所以溶液中的溶质是NaNO3,用惰性电极电解硝酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,结合电解方程式计算.
解答 解:在纯水中加入物质的量相等的Ag+、Na+、Pb2+、Cl-、SO42-、NO3-,Ag+、Cl-反应生成AgCl沉淀,Pb2+和SO42-生成PbSO4沉淀,所以溶液中的溶质是NaNO3,用惰性电极电解硝酸钠溶液时,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,氧化产物是氧气、还原产物是氢气,电解方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,
氧化产物与还原产物物质的量之比1:2,
故选D.
点评 本题以电解原理考查了离子共存、离子放电顺序,明确溶液中的溶质及离子放电顺序是解本题关键,很多同学往往漏掉离子共存而导致错误,为易错点.

练习册系列答案
相关题目
3.在HNO2溶液中存在如下平衡:HNO2?H++NO2-,向该溶液中加入少量的下列物质后,能使电离平衡向右移动且使H+增多的是( )
| A. | 水 | B. | NaOH溶液 | C. | NaNO2溶液 | D. | HNO3 |
8.下列物质属于电解质的是( )
| A. | 氧气 | B. | 氯化氢 | C. | 二氧化硫 | D. | 铜 |
18.A、Y、Z、W为四种短周期元素,X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地球中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2.下列说法不正确的是( )
| A. | X的氢化物可以是两种液体 | |
| B. | Y的单质能把溴从溴化物中置换出来 | |
| C. | Z的氧化物通常形成分子晶体 | |
| D. | 存放W单质的仓库失火不能用CO2灭火 |
5.固体粉末M中可能含有Cu、FeO、Fe2O3、K2SO3、Na2CO3、KCl中的若干种.为确定该固体粉末的成分,现取M进行下列实验,实验过程及现象如下:下列有关说法正确的是( )

| A. | 气体乙中一定含有CO2可能含有SO2 | |
| B. | 白色沉淀丁一定是AgCl | |
| C. | 固体粉末M中一定含有Cu、FeO,可能含有Fe2O3 | |
| D. | 固体乙中一定含有Fe2O3和CuO |
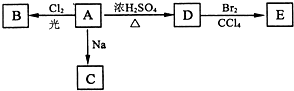
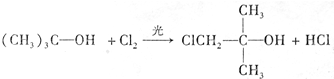 ;A转化为D的反应的类型消去反应.
;A转化为D的反应的类型消去反应.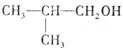 .
.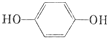 .
.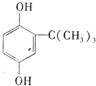 .
.