题目内容
18.A、Y、Z、W为四种短周期元素,X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地球中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2.下列说法不正确的是( )| A. | X的氢化物可以是两种液体 | |
| B. | Y的单质能把溴从溴化物中置换出来 | |
| C. | Z的氧化物通常形成分子晶体 | |
| D. | 存放W单质的仓库失火不能用CO2灭火 |
分析 X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍,则X为氧元素;Z在地球中的含量仅次于氧,则Z为硅元素;Y元素的最高正价与最低负价的代数和为6,则Y的最高价为+7价,所以Y为氯元素;Y、Z、W同周期,W的常见化合价为+2价,则W为镁元素,根据元素周期律的递变规律,再结合选项判断.
解答 解:X、Y、Z、W为四种短周期元素.X原子最外层电子数是核外电子层数的3倍,则X为氧元素;Z在地球中的含量仅次于氧,则Z为硅元素;Y元素的最高正价与最低负价的代数和为6,则Y的最高价为+7价,所以Y为氯元素;Y、Z、W同周期,W的常见化合价为+2价,则W为镁元素.
A.X的氢化物为水、过氧化氢,二者均为液体,故A正确;
B.氯气能把溴从溴化物中置换出来,故B正确;
C.Z的氧化物是二氧化硅,属于原子晶体,故C错误;
D.镁能与二氧化碳反应生成碳与氧化镁,故存放W单质的仓库失火不能用CO2灭火,故D正确.
故选:C.
点评 本题考查位置结构性质的相互关系应用,题目难度不大,注意把握从化合价的角度推断元素的种类,学习中注意对基础知识的掌握.

练习册系列答案
相关题目
9.下列反应的离子方程式书写正确的是( )
| A. | 氯气和水的反应:C12+H2O=2H++Cl-+ClO- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+=BaSO4↓+H2O |
6. 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
①正向反应的反应热△H>0(“>”“<”“=”);
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
| 反应温度 | 300℃ | 400℃ | 500℃ | 600℃ | 700℃ |
| 平衡常数 | 3.8 | 5.7 | 8.5 | 9.2 | 9.8 |
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
13.向水中加入等物质的量Ag+、Na+、Pb2+、Cl-、SO42-、NO3-,用惰性电极电解所得溶液,一段时间后氧化产物与还原产物物质的量之比为( )
| A. | 8:1 | B. | 2:1 | C. | 1:1 | D. | 1:2 |
3.下列说法正确的是( )
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯(C4H6)分别在空气中充分燃烧,所耗用氧气的量依次增大 | |
| C. | 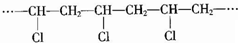 的单体是Cl-CH=CH2 的单体是Cl-CH=CH2 | |
| D. | 按系统命名法,化合物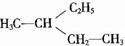 的名称为2-乙基丁烷 的名称为2-乙基丁烷 |
10.下列有关说法正确的是( )
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 | |
| B. | 由苯制取溴苯、硝基苯、环己烷的反应类型均属于取代反应 | |
| C. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙酸乙酯、乙酸、乙醇均能和水互溶 |
8.用下列装置图进行相应的实验,其中正确的是( )
| A. | 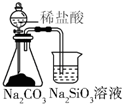 用此图可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 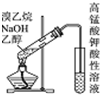 用此图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| C. |  根据此图装置中U型管液面现象,证明装置漏气 | |
| D. | 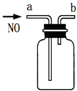 用此图装置收集一瓶纯净的NO |