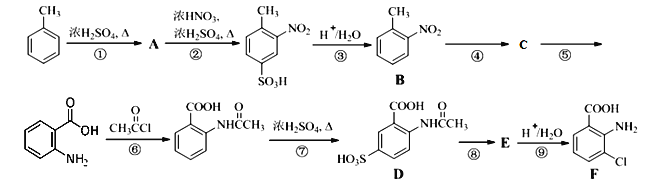
题目内容
【题目】为了探究不溶性盐X(仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。

请回答:
(1)X的组成元素为H、O和______(用元素符号表示),气体C的电子式为_______。
(2)写出反应①的离子方程式:______________。
【答案】 N、S、Cu ![]() 2NH4CuSO3+4H+
2NH4CuSO3+4H+![]() Cu+Cu2++2SO2↑+2H2O+2N
Cu+Cu2++2SO2↑+2H2O+2N![]()
【解析】试题分析:根据实验现象结合相关物质的性质,分析判断元素种类。根据相关物质的物质的量计算X的组成。
解析:A气体使品红溶液褪色,A是SO2,物质的量是0.1mol,说明X中含有亚硫酸根或亚硫酸氢根离子。B是红色固体,应该是铜,物质的量是0.05mol;蓝色溶液和氢氧化钠反应生成C气体和蓝色沉淀,说明C是氨气,物质的量是0.1mol,即X中含有铵根;蓝色沉淀灼烧生成黑色固体D,D是氧化铜,物质的量是0.05mol。因此铜元素的物质的量是0.1mol,则X中铜元素、铵根和亚硫酸根(或亚硫酸氢根的)的物质的量之比是1:1:1,而0.1molNH4CuSO3的质量恰好是16.2g。
(1)根据以上分析可知X的组成元素为H、O和N、S、Cu。氨气的电子式为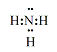 。
。
(2)根据以上分析可知反应①的离子方程式为2NH4CuSO3+4H+=Cu+Cu2++2SO2↑+2H2O+2NH4+。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污
泥中Cr(Ⅲ)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
___________________________________________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为__________(填微粒的化学式)
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式______________________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是____(选填编号),滴定终点现象是________________________。
A.NaCl B.K2CrO4 C.KI D.NaCN