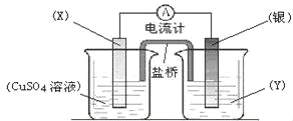
题目内容
【题目】VL Al2(SO4)3溶液中含a g Al3+,从中取出V/2L,并稀释至V L,则稀释后SO42—的物质的量浓度为
A. a/(54V)mol·L—1 B. a/(18V)mol·L—1 C. a/(36V)mol·L—1 D. a/(27V)mol·L—1
【答案】C
【解析】
根据n=m/M计算出ag铝离子的物质的量,再根据硫酸铝的化学式计算出硫酸根离子的物质的量,从而可以知道取出的V/2L,溶液中含有硫酸根离子的物质的量,然后根据稀释过程中溶质的物质的量不变计算出稀释后溶液中硫酸根离子的浓度.
VL Al2(SO4)3溶液中含a g Al3+,含有铝离子的物质的量为:![]() ,根据化学式 Al2(SO4)3可以知道,VL 该溶液中含有硫酸根离子的物质的量为:
,根据化学式 Al2(SO4)3可以知道,VL 该溶液中含有硫酸根离子的物质的量为:![]() ,
,
从中取出V/2L,取出的溶液中含有硫酸根离子的物质的量为![]() ,稀释过程中硫酸根离子的物质的量不变,则稀释后SO42—的物质的量浓度为:
,稀释过程中硫酸根离子的物质的量不变,则稀释后SO42—的物质的量浓度为:![]() ;
;
综上所述,本题应选C。

 名校课堂系列答案
名校课堂系列答案【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行了探究。己知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g)CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) | △H3 | K3 | |||
请回答下列问题:
(1)反应②是_______(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示);根据反应③判断△S_______(填“>”“=”或“<”)0,在_______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______(填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g的浓度分别为 0.1mol/L、0.8 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)_______v(逆) (填“>”“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升高温度,t1时平衡,t2时减小压强,t3时增大CO的浓度,t4时又达到平衡。在下图中画出t2至t4的曲线。_____

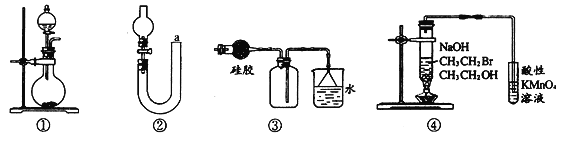
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
A.用CCl4提取溴水中的Br2[来 | B.从KI和I2的固体混合物中回收I2 | C.吸收NH3(极易溶于水),并防止倒吸 | D.工业酒精制备无水酒精 |
|
|
|
|
A. A B. B C. C D. D