题目内容
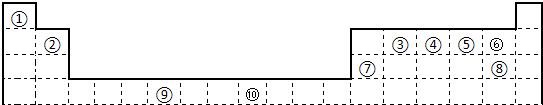
下表为长式周期表的一部分,其中的编号代表对应的元素.
(1)写出上表中元素⑨原子的外围电子排布式
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
(3)按要求完成下列各题
a.第一电离能:元素④
b.与元素④所形成的单质互为等电子体的分子、离子的化学式
c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质.则其负极反应式为
(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子.0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:
(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 已知该原子的半径为d,相对原子质量为M,NA代表阿伏加德罗常数,请回答:
晶体中该原子的配位数为
(用字母表示)
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |
3d54s1
3d54s1
.(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为:
sp2
sp2
(3)按要求完成下列各题
a.第一电离能:元素④
>
>
元素⑤(选填“>”、“=”、“<”).b.与元素④所形成的单质互为等电子体的分子、离子的化学式
CO
CO
、C22-
C22-
(各写一种).c.元素④的气态氢化物X的水溶液在微电子工业中,可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
2NH3.H2O+3H2O2═N2+8H2O
2NH3.H2O+3H2O2═N2+8H2O
d.由X与氧气、KOH溶液构成原电池,负极会产生元素④的单质.则其负极反应式为
2NH3+6OH--6e-═N2+6H2O
2NH3+6OH--6e-═N2+6H2O
.(4)由元素③和⑧形成的液态化合物Z,是非极性的直线形分子.0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol
CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol
(5)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:
分子之间形成氢键
分子之间形成氢键
.(6)元素⑩所形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示. 已知该原子的半径为d,相对原子质量为M,NA代表阿伏加德罗常数,请回答:

晶体中该原子的配位数为
12
12
,一个晶胞中包含的原子数目为4
4
;该晶体的密度为| M | ||
4
|
| M | ||
4
|
分析:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为S,⑨为V,⑩为Ni,
(1)⑨为V,原子序数为23;
(2)③与①形成的水果催熟剂气体化合物为乙烯;
(3)a.N原子的最外层p电子半满,为稳定结构;
b.元素④所形成的单质为N2,原子数、价电子数相同的微粒为等电子体;
c.一水合氨与过氧化氢反应生成氮气和水;
d.X与氧气、KOH溶液构成原电池,负极会产生元素④的单质,则负极N原子失去电子;
(4)元素③和⑧形成的液态化合物Z,是非极性的直线形分子,Z为CS2,0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ,则1mol完全燃烧放出1075kJ的热量;
(5)①与⑥形成化合物为HF,分子之间形成氢键;
(6)由甲图可知,原子紧密堆积,由乙可知,个晶胞中包含的原子数目为8×
+6×
=4个,利用ρ=
计算密度.
(1)⑨为V,原子序数为23;
(2)③与①形成的水果催熟剂气体化合物为乙烯;
(3)a.N原子的最外层p电子半满,为稳定结构;
b.元素④所形成的单质为N2,原子数、价电子数相同的微粒为等电子体;
c.一水合氨与过氧化氢反应生成氮气和水;
d.X与氧气、KOH溶液构成原电池,负极会产生元素④的单质,则负极N原子失去电子;
(4)元素③和⑧形成的液态化合物Z,是非极性的直线形分子,Z为CS2,0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ,则1mol完全燃烧放出1075kJ的热量;
(5)①与⑥形成化合物为HF,分子之间形成氢键;
(6)由甲图可知,原子紧密堆积,由乙可知,个晶胞中包含的原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
解答:解:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为S,⑨为V,⑩为Ni,
(1)⑨为V,原子序数为23,则外围电子排布式为3d54s1,故答案为:3d54s1;
(2)③与①形成的水果催熟剂气体化合物为乙烯,C原子上没有孤对电子,成键数为3,则C原子为sp2杂化,故答案为:sp2;
(3)a.N原子的最外层p电子半满,为稳定结构,则N原子的第一电离能大,故答案为:>;
b.元素④所形成的单质为N2,原子数、价电子数相同的微粒为等电子体,互为等电子体的分子、离子的化学式为CO、C22-,故答案为:CO;C22-;
c.一水合氨与过氧化氢反应生成氮气和水,该反应为2NH3.H2O+3H2O2═N2+8H2O,故答案为:2NH3.H2O+3H2O2═N2+8H2O;
d.X与氧气、KOH溶液构成原电池,负极会产生元素④的单质,则负极N原子失去电子,负极反应为2NH3+6OH--6e-═N2+6H2O,故答案为:2NH3+6OH--6e-═N2+6H2O;
(4)元素③和⑧形成的液态化合物Z,是非极性的直线形分子,Z为CS2,0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ,则1mol完全燃烧放出1075kJ的热量,热化学方程式为CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol,
故答案为:CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol;
(5)①与⑥形成化合物为HF,分子之间形成氢键,则相对分子质量实验测得的值一般高于理论值,故答案为:分子之间形成氢键;
(6)由甲图可知,原子紧密堆积,则晶体中该原子的配位数为12,由乙可知,个晶胞中包含的原子数目为8×
+6×
=4个,
该原子的半径为d,由丙图可知,图中三角形的斜边为4d,晶胞中的边长为2
d,其体积为16
d3,由ρ=
可知,ρ=
=
,
故答案为:12;4;
.
(1)⑨为V,原子序数为23,则外围电子排布式为3d54s1,故答案为:3d54s1;
(2)③与①形成的水果催熟剂气体化合物为乙烯,C原子上没有孤对电子,成键数为3,则C原子为sp2杂化,故答案为:sp2;
(3)a.N原子的最外层p电子半满,为稳定结构,则N原子的第一电离能大,故答案为:>;
b.元素④所形成的单质为N2,原子数、价电子数相同的微粒为等电子体,互为等电子体的分子、离子的化学式为CO、C22-,故答案为:CO;C22-;
c.一水合氨与过氧化氢反应生成氮气和水,该反应为2NH3.H2O+3H2O2═N2+8H2O,故答案为:2NH3.H2O+3H2O2═N2+8H2O;
d.X与氧气、KOH溶液构成原电池,负极会产生元素④的单质,则负极N原子失去电子,负极反应为2NH3+6OH--6e-═N2+6H2O,故答案为:2NH3+6OH--6e-═N2+6H2O;
(4)元素③和⑧形成的液态化合物Z,是非极性的直线形分子,Z为CS2,0.2mol的Z在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ,则1mol完全燃烧放出1075kJ的热量,热化学方程式为CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol,
故答案为:CS2(l)+3O2(g)═CO2(g)+2SO2(g)△H=-1075kJ/mol;
(5)①与⑥形成化合物为HF,分子之间形成氢键,则相对分子质量实验测得的值一般高于理论值,故答案为:分子之间形成氢键;
(6)由甲图可知,原子紧密堆积,则晶体中该原子的配位数为12,由乙可知,个晶胞中包含的原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
该原子的半径为d,由丙图可知,图中三角形的斜边为4d,晶胞中的边长为2
| 2 |
| 2 |
| m |
| V |
| ||
| V |
| M | ||
4
|
故答案为:12;4;
| M | ||
4
|
点评:本题考查较综合,涉及知识点较多,涉及元素周期表和周期律、电子排布、原电池、热化学反应、氢键、晶胞计算等,注重高考常考点的考查,题目难度较大,对学生的心理和应试能力都是极大的挑战.

练习册系列答案
相关题目