题目内容
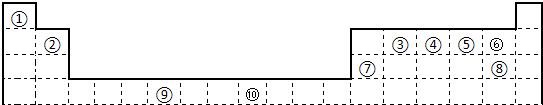
下表为长式周期表的一部分,其中的编号代表对应的元素.
试填空.
(1)写出上表中元素⑩原子的外围电子排布式
(2)元素③与⑥形成的化合物中元素③的杂化方式为:
(3)元素④、⑤、⑥的第一电离能大小顺序是:
(4)元素④、⑤、⑥与①形成的最简单化合物中沸点最高的为:
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑨与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应生成盐的化学式
(6)⑦、⑧两种元素分别与⑥在一定条件下形成的晶体中熔点较高的为:
实验化学.
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
| ⑩ |
(1)写出上表中元素⑩原子的外围电子排布式
3d54s1
3d54s1
.(2)元素③与⑥形成的化合物中元素③的杂化方式为:
sp3
sp3
杂化,其形成的化合物的晶体类型是:分子晶体
分子晶体
.(3)元素④、⑤、⑥的第一电离能大小顺序是:
F>N>O
F>N>O
(用元素符号表示);请写出与N3-互为等电子体的分子、离子的化学式CO2
CO2
,CNO-
CNO-
(各写一种).(4)元素④、⑤、⑥与①形成的最简单化合物中沸点最高的为:
H2O
H2O
(填化学式),理由为:因为水分子之间形成的氢键数多
因为水分子之间形成的氢键数多
.(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑨与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应生成盐的化学式
Na2BeO2
Na2BeO2
.(6)⑦、⑧两种元素分别与⑥在一定条件下形成的晶体中熔点较高的为:
MgF2
MgF2
(填化学式),其理由为:因为MgF2晶体的晶格能大于NaF晶体的晶格能
因为MgF2晶体的晶格能大于NaF晶体的晶格能
.实验化学.
分析:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为Al,⑩为Cr,
(1)根据电子排布规律及半充满为稳定状态来分析;
(2)根据成键判断杂化类型,根据构成微粒来分析晶体类型;
(3)非金属性越强,第一电离能越大,根据原子的质子数、原子个数来分析等电子体;
(4)根据氢键来分析氢化物的沸点;
(5)根据性质的相似性可知,氢氧化铝与氢氧化钠反应,则氢氧化铍能与氢氧化钠反应;
(6)根据离子的电荷、半径来分析离子晶体的晶格能和沸点.
(1)根据电子排布规律及半充满为稳定状态来分析;
(2)根据成键判断杂化类型,根据构成微粒来分析晶体类型;
(3)非金属性越强,第一电离能越大,根据原子的质子数、原子个数来分析等电子体;
(4)根据氢键来分析氢化物的沸点;
(5)根据性质的相似性可知,氢氧化铝与氢氧化钠反应,则氢氧化铍能与氢氧化钠反应;
(6)根据离子的电荷、半径来分析离子晶体的晶格能和沸点.
解答:解:由元素在周期表中的位置可知,①为H,②为Be,③为C,④为N,⑤为O,⑥为F,⑦为Na,⑧为Mg,⑨为Al,⑩为Cr,
(1)Cr的原子序数为24,3d电子半满时为稳定状态,则外围电子排布式为3d54s1,故答案为:3d54s1;
(2)在CF4中,C原子上没有孤对电子,成键数为4,则C原子为sp3杂化,其构成微粒为分子,则属于分子晶体,故答案为:sp3;分子晶体;
(3)非金属性F的最强,第一电离能最大,但N原子为2p3的半满状态,则第一电离能N>O,第一电离能为F>N>O;N3-的原子数为3,电子数为7×3+1=22,CO2、CS2、N2O、BeCl2、CNO-、SCN-的原子数为3,电子数都是22,则N3-与互为等电子体,故答案为:F>N>O;CO2(或CS2、N2O、BeCl2);CNO-(或SCN-);
(4)氨气、水、氟化氢中均存在氢键,但水中的氢键数最多,则沸点最高,故答案为:H2O;因为水分子之间形成的氢键数多;
(5)因Al与Be的性质相似,则Be(OH)2+2NaOH═Na2BeO2+2H2O,故答案为:Na2BeO2;
(6)因镁离子带的电荷大于钠离子带的电荷,且镁离子的半径小,则MgF2晶体的晶格能大于NaF晶体的晶格能,MgF2的熔点较高,
故答案为:MgF2;因为MgF2 晶体的晶格能大于NaF晶体的晶格能.
(1)Cr的原子序数为24,3d电子半满时为稳定状态,则外围电子排布式为3d54s1,故答案为:3d54s1;
(2)在CF4中,C原子上没有孤对电子,成键数为4,则C原子为sp3杂化,其构成微粒为分子,则属于分子晶体,故答案为:sp3;分子晶体;
(3)非金属性F的最强,第一电离能最大,但N原子为2p3的半满状态,则第一电离能N>O,第一电离能为F>N>O;N3-的原子数为3,电子数为7×3+1=22,CO2、CS2、N2O、BeCl2、CNO-、SCN-的原子数为3,电子数都是22,则N3-与互为等电子体,故答案为:F>N>O;CO2(或CS2、N2O、BeCl2);CNO-(或SCN-);
(4)氨气、水、氟化氢中均存在氢键,但水中的氢键数最多,则沸点最高,故答案为:H2O;因为水分子之间形成的氢键数多;
(5)因Al与Be的性质相似,则Be(OH)2+2NaOH═Na2BeO2+2H2O,故答案为:Na2BeO2;
(6)因镁离子带的电荷大于钠离子带的电荷,且镁离子的半径小,则MgF2晶体的晶格能大于NaF晶体的晶格能,MgF2的熔点较高,
故答案为:MgF2;因为MgF2 晶体的晶格能大于NaF晶体的晶格能.
点评:本题考查元素周期表和元素周期律,难度较大,熟悉物质的结构和性质是解答本题的关键.

练习册系列答案
相关题目