题目内容
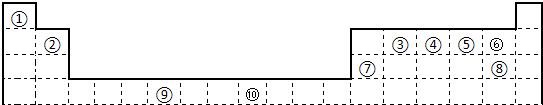
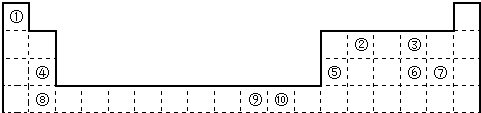
下表为长式周期表的一部分,其中的编号代表对应的元素.
请回答下列问题:
(1)表中属于d区的元素是
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
(5)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O6]2+显粉红色.据此判断,[Mn(H2O6]2+

请回答下列问题:
(1)表中属于d区的元素是
⑨
⑨
(填编号).
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
MgCNi3
MgCNi3
(用对应的元素符号表示).(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是
BD
BD
.A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为
1
1
;该元素与元素①形成的分子X构形为三角锥型
三角锥型
;X在①与③形成的分子Y中的溶解度很大,其主要原因是NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键
NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键
.(5)A、B均为短周期金属元素.依据下表数据,写出B原子的电子排布式:
1s22s22p63s2
1s22s22p63s2
.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
有
有
颜色(填“无”或“有”).分析:(1)d区的元素第ⅢB~ⅦB、Ⅷ族(镧系元素、锕系元素除外),为第3列到10列元素;
(2)由元素指周期表中的位置可知,②为C元素、④为Mg元素、⑨为Ni元素,根据晶胞结构,利用均摊法计算晶胞中各原子数目,据此书写化学式;
(3)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,C元素电负性不大,分子中不存在氢键,为对称结构,属于非极性分子,分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,根据杂化轨道数目确定杂化方式,据此结合选项解答;
(4)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,为N原子,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键;
(5)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,根据原子核外电子排布规律书写;
(6)根据核外电子排布规律,书写Mn2+的核外电子排布式,据此结合题目信息判断.
(2)由元素指周期表中的位置可知,②为C元素、④为Mg元素、⑨为Ni元素,根据晶胞结构,利用均摊法计算晶胞中各原子数目,据此书写化学式;
(3)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,C元素电负性不大,分子中不存在氢键,为对称结构,属于非极性分子,分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,根据杂化轨道数目确定杂化方式,据此结合选项解答;
(4)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,为N原子,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键;
(5)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,根据原子核外电子排布规律书写;
(6)根据核外电子排布规律,书写Mn2+的核外电子排布式,据此结合题目信息判断.
解答:解:(1)d区的元素第ⅢB~ⅦB、Ⅷ族(镧系元素、锕系元素除外),为第3列到10列元素,由元素在周期表中的位置可知,⑨处于第10列,为第Ⅷ族,属于d区元素,故答案为:⑨;
(2)由元素指周期表中的位置可知,②为C元素、④为Mg元素、⑨为Ni元素,根据晶胞结构可知,晶胞中C原子数目为1,Mg原子数目为8×
=1,Ni原子数目为6×
=3,该物质化学式为:MgCNi3,故答案为:MgCNi3;
各原子数目,据此书写化学式;
(3)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,
A.C元素电负性不大,分子中不存在氢键,故A错误
B.乙烯为对称结构,属于非极性分子,故B正确;
C.分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,含有5个σ键和1个π键,故C错误;
D.C原子呈1个C=C双键、2个C-H键,杂化轨道数为3,原子采用sp2杂化,故D正确;
故答案为:BD;
(4)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,该原子外层电子的孤对电子数
为1,为N元素,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键,故NH3在H2O中的溶解度很大,
故答案为:1,三角锥型,NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键;
(5)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,原子的电子排布式为1s22s22p63s2,
故答案为:1s22s22p63s2;
(6)Mn2+的核外电子排布式为1s22s22p63s23p63d8,d能级为排满电子,故,[Mn(H2O6)]2+ 有颜色,故答案为:有.
(2)由元素指周期表中的位置可知,②为C元素、④为Mg元素、⑨为Ni元素,根据晶胞结构可知,晶胞中C原子数目为1,Mg原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
各原子数目,据此书写化学式;
(3)②为C元素,碳元素一种氢化物是的产量作为衡量石油化工发展水平的标志,该氢化物为C2H4,
A.C元素电负性不大,分子中不存在氢键,故A错误
B.乙烯为对称结构,属于非极性分子,故B正确;
C.分子中含有1个C=C双键、4个C-H键,单键为σ键,双键中1个σ键、1个π键,含有5个σ键和1个π键,故C错误;
D.C原子呈1个C=C双键、2个C-H键,杂化轨道数为3,原子采用sp2杂化,故D正确;
故答案为:BD;
(4)某元素的特征电子排布式为nsnnpn+1,则n=2,故该元素的特征电子排布式为2s22p3,该原子外层电子的孤对电子数
为1,为N元素,元素①为H元素,与X形成的物质为NH3,为三角锥型,①与③形成的分子为H2O,NH3与H2O都是极性分子,且分子之间能形成氢键,故NH3在H2O中的溶解度很大,
故答案为:1,三角锥型,NH3与H2O都是极性分子,根据相似相溶原理,极性分子易溶于极性溶剂中,且分子之间能形成氢键;
(5)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故B为Mg元素,原子的电子排布式为1s22s22p63s2,
故答案为:1s22s22p63s2;
(6)Mn2+的核外电子排布式为1s22s22p63s23p63d8,d能级为排满电子,故,[Mn(H2O6)]2+ 有颜色,故答案为:有.
点评:本题考查元素周期表的结构、晶胞计算、分子结构与性质、电离能等,难度中等,注意(5)中电离能与化合价的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目