题目内容
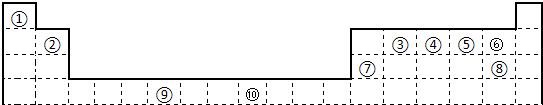
下表为长式周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)表中属于d区的元素是
(2)③和⑦形成的常见化合物的晶体类型是
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中
(4)在⑧元素的硫酸盐溶液中加入过量的x的水溶液,可生成的配合物的化学式
(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为

请回答下列问题:
(1)表中属于d区的元素是
⑨
⑨
(填编号).元素⑧的原子外围电子排布式3d104s1
3d104s1
;(2)③和⑦形成的常见化合物的晶体类型是
分子晶体
分子晶体
;②、③、④的电负性O
O
>N
N
>C
C
(用元素符号表示).判断依据同周期元素从左到右的非金属性逐渐增强
同周期元素从左到右的非金属性逐渐增强
;(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中
②
②
(填编号);该元素与元素①形成的化合物x极易溶于水的原因是氨气和水都是极性分子,氨气和水分子之间可以形成分子间氢键
氨气和水都是极性分子,氨气和水分子之间可以形成分子间氢键
;(4)在⑧元素的硫酸盐溶液中加入过量的x的水溶液,可生成的配合物的化学式
[Cu(NH3)4]SO4
[Cu(NH3)4]SO4
,简要描述该配合物中化学键的成键情况NH3和Cu2+之间以配位键结合,SO42-和配离子之间以离子键结合
NH3和Cu2+之间以配位键结合,SO42-和配离子之间以离子键结合
;(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为
C3N4
C3N4
,其硬度比金刚石大
大
(填“大”或“小”).分析:由元素在周期表中的位置可知,①为H,②为N,③为C,④为O,⑤为Al,⑥为S、⑦为Cl,⑧为Cu,⑨为Fe,
(1)由图可知⑨处于d区;根据核外电子排布规律书写Cu的外围电子排布;
(2))③和⑦形成的常见化合物为CCl4,属于分子晶体;
同周期元素从左到右的非金属性逐渐增强,电负性增强;
(3)元素的特征电子排布式(价电子排布式)为nsnnpn+1,则n=2,故为2s22p3,为N元素;
根据形似相溶与氢键分析氨气极易溶于水;
(4)铜离子与氨分子形成配位键,故形成的配合物为[Cu(NH3)4]SO4;
(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料为C3N4,根据键长分析判断与金刚石的硬度大小.
(1)由图可知⑨处于d区;根据核外电子排布规律书写Cu的外围电子排布;
(2))③和⑦形成的常见化合物为CCl4,属于分子晶体;
同周期元素从左到右的非金属性逐渐增强,电负性增强;
(3)元素的特征电子排布式(价电子排布式)为nsnnpn+1,则n=2,故为2s22p3,为N元素;
根据形似相溶与氢键分析氨气极易溶于水;
(4)铜离子与氨分子形成配位键,故形成的配合物为[Cu(NH3)4]SO4;
(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料为C3N4,根据键长分析判断与金刚石的硬度大小.
解答:解:由元素在周期表中的位置可知,①为H,②为N,③为C,④为O,⑤为Al,⑥为S、⑦为Cl,⑧为Cu,⑨为Fe,
(1)由图可知⑨处于d区;Cu原子核外电子数为29,故Cu原子的外围电子排布3d104s1,故答案为:⑨;3d104s1;
(2))③和⑦形成的常见化合物为CCl4,属于分子晶体;同周期元素从左到右的非金属性逐渐增强,电负性增强,故电负性O>N>C,
故答案为:分子晶体;O;N;C;同周期元素从左到右的非金属性逐渐增强;
(3)元素的特征电子排布式(价电子排布式)为nsnnpn+1,则n=2,故为2s22p3,为N元素,为表中②;
氨气和水都是极性分子,氨气和水分子之间可以形成分子间氢键,故氨气极易溶于水;
故答案为:②;氨气和水都是极性分子,氨气和水分子之间可以形成分子间氢键;
(4)NH3和Cu2+之间以配位键结合,SO42-和配离子之间以离子键结合,故形成的配合物为[Cu(NH3)4]SO4,
故答案为:[Cu(NH3)4]SO4;NH3和Cu2+之间以配位键结合,SO42-和配离子之间以离子键结合;
(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料为C3N4,属于原子晶体,C-N键长小于金刚石中C-C键长,故C-N更稳定,C3N4的硬度比金刚石大,
故答案为:C3N4;大.
(1)由图可知⑨处于d区;Cu原子核外电子数为29,故Cu原子的外围电子排布3d104s1,故答案为:⑨;3d104s1;
(2))③和⑦形成的常见化合物为CCl4,属于分子晶体;同周期元素从左到右的非金属性逐渐增强,电负性增强,故电负性O>N>C,
故答案为:分子晶体;O;N;C;同周期元素从左到右的非金属性逐渐增强;
(3)元素的特征电子排布式(价电子排布式)为nsnnpn+1,则n=2,故为2s22p3,为N元素,为表中②;
氨气和水都是极性分子,氨气和水分子之间可以形成分子间氢键,故氨气极易溶于水;
故答案为:②;氨气和水都是极性分子,氨气和水分子之间可以形成分子间氢键;
(4)NH3和Cu2+之间以配位键结合,SO42-和配离子之间以离子键结合,故形成的配合物为[Cu(NH3)4]SO4,
故答案为:[Cu(NH3)4]SO4;NH3和Cu2+之间以配位键结合,SO42-和配离子之间以离子键结合;
(5)②、③形成一种超硬、耐磨、耐高温的新型无机非金属材料为C3N4,属于原子晶体,C-N键长小于金刚石中C-C键长,故C-N更稳定,C3N4的硬度比金刚石大,
故答案为:C3N4;大.
点评:本题考查元素周期表与周期律的综合应用、核外电子排布规律、化学键、晶体类型与性质等,难度中等,注意掌握周期表的结构.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目