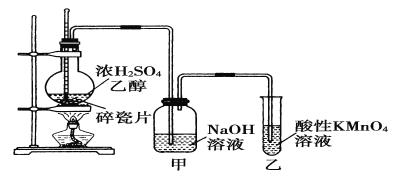
题目内容
【题目】已知反应:
①C(s)+1/2O2(g)=CO(g) ΔH1=-110.5kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3kJ/mol
下列结论正确的是( )
A.若碳的燃烧热用ΔH3来表示,则ΔH3<ΔH1
B.H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.稀醋酸与稀NaOH溶液反应生成 1mol水,放出的热量小于57.3kJ
【答案】AD
【解析】
A. 燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,又C(s)+![]() O2(g)═CO(g)△H1=-110.5kJ/mol,该反应没有生成稳定氧化物,则碳燃烧生成稳定氧化物时放出热量大,所以△H3<△H1,故A正确;
O2(g)═CO(g)△H1=-110.5kJ/mol,该反应没有生成稳定氧化物,则碳燃烧生成稳定氧化物时放出热量大,所以△H3<△H1,故A正确;
B. 中和热必须是生成1molH2O所放出的热量,与几元酸、碱无关,而H2SO4和Ca(OH)2反应除生成水以外还生成硫酸钙沉淀,放出更多的热量,则H2SO4和Ca(OH)2反应的△H<2×(-57.3)kJ/mol,故B错误;
C. 很多放热反应也需要条件才发生,如碳的燃烧反应,需要加热才发生,但是该反应为放热反应,故C错误;
D. 醋酸电离要吸热,则稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3kJ,故D正确。
故选:AD。

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目