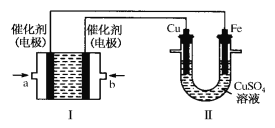
题目内容
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
下列说法错误的是( )
A.CH3OH转变成H2的反应不一定要吸收能量
B.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ
C.反应①中的能量变化如图所示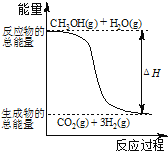
D.根据反应①和②推知:H2(g)+1/2O2(g)=H2O(g) ΔH=-241.9kJ/mol
【答案】C
【解析】
A. CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,故A正确;
B. 反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水,氢气燃烧生成水也为放热反应,根据盖斯定律可知1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ,故B正确;
C. 反应①焓变大于零为吸热反应,图示为放热反应的能量变化,故C错误;
D. 根据盖斯定律,将②-①可得:H2(g)+![]() O2(g)=H2O(g)的△H=-241.9kJ/mol,故D正确;
O2(g)=H2O(g)的△H=-241.9kJ/mol,故D正确;
故答案为C。

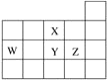
【题目】下列依据相关实验得出的结论正确的是
选项 | 实验步骤 | 现象 | 结论 |
A | 浓硫酸与乙醇加热,产生的气体X直接通入溴水 | 溴水褪色 | X一定是纯净的乙烯 |
B | 某卤代烃CH3CH2X与NaOH溶液加热至不再分层,冷却后加稀硝酸至酸性,再滴加 | 生成淡黄色沉淀 | X为溴原子 |
C | 向苯酚溶液中滴加少量浓溴水、振荡, | 无白色沉淀 | 苯酚浓度小 |
D | 鸡蛋白溶液中分别加入饱和(NH4)2SO4溶液和HgCl2溶液 | 均有白色沉淀 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D