题目内容
【题目】电化学技术在工业生产中有着重要的作用。请回答:
(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉。铂吸附气体的能力强,性质稳定。
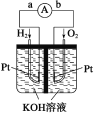
①氢氧燃料电池能量转化的主要形式是__。
②负极反应式为__。
③电极表面镀铂粉的原因是__。
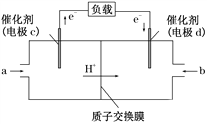
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
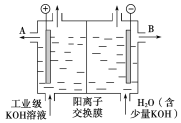
①该电解槽的阳极反应式是___。
②通电开始后,阴极附近溶液pH会增大,请简述原因___。
③除去杂质后的氢氧化钾溶液从液体出口___(填写“A”或“B”)导出。
【答案】化学能转变为电能 H2-2e-+2OH-=2H2O 增大电极单位面积吸附H2、O2分子数,加快反应速率 4OH--4e-=2H2O+O2↑ H+放电,促进水的电离,OH-浓度增大 B
【解析】
(1)①原电池是把化学能转化为电能的装置,故答案为:化学能转变为电能;
②氢气在负极通入,电解质溶液显碱性,则负极的电极反应式H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
③根据题目信息“电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定”可知电极表面镀铂粉的原因是为了增大气体的吸附面积,保证气体充分参与电极反应,加快反应速率,故答案为:增大电极单位面积吸附H2、O2分子数,加快反应速率;
(2)①用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,阳极发生氧化反应,故电解时阳极OH-失去电子,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②阴极电极反应式4H++4e-=2H2↑,其中阴极区H+放电,H+浓度减小,使得水的电离平衡向右移动促进水的电离,溶液中OH-浓度增大,阴极附近pH会增大,故答案为:H+放电,促进水的电离,OH-浓度增大;
③在阴极区聚集大量的K+和OH-,从而产生纯的KOH溶液,除杂后的KOH溶液从B口导出,故答案为:B。