题目内容
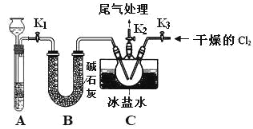
【题目】Ⅰ.某厂废水中含KCN,其浓度为0.01 mol·L-1,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):
KCN+2KOH+Cl2===KOCN+2KCl+H2O
(1)上述反应中被氧化的元素是________(用元素符号表示)。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:______________
______KOCN+______Cl2+______![]() ===______K2CO3+______N2+______KCl+______
===______K2CO3+______N2+______KCl+______![]()
(3)若将10 L含KCN的浓度为0.01 mol·L-1的废水中KCN氧化除去,最少需要氯气________ mol。
Ⅱ.某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。
(4)现实验室需用480 mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需________。
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO![]() ,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为_________________。
,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为_________________。
【答案】C 2 3 8 KOH 2 1 6 4 H2O 0.25 500 mL容量瓶 ![]() +4Cl2+5H2O===2
+4Cl2+5H2O===2![]() +8Cl-+10H+
+8Cl-+10H+
【解析】
(1)化合价升高元素在反应中被氧化。
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故![]() 系数为1, Cl2系数为3,结合原子守恒配平其它物质的系数。
系数为1, Cl2系数为3,结合原子守恒配平其它物质的系数。
(3)1 mol KCN最终被氧化为碳酸钾和氮气,失去5 mol电子,1氯气得到2 mol电子,根据电子得失守恒列方程求解。
(4)常见的容量瓶有50mL、100 mL、250 mL、500 mL等规格。
(5)Na2S2O3被氯气氧化为SO![]() ,Cl2被还原为Cl-,根据电子得失守恒、电荷守恒和原子守恒写出离子方程式。
,Cl2被还原为Cl-,根据电子得失守恒、电荷守恒和原子守恒写出离子方程式。
(1)反应KCN+2KOH+Cl2===KOCN+2KCl+H2O中氯元素化合价降低,被还原;碳元素化合价从+2价升高到+4价,失去电子,因此被氧化的元素是C;正确答案:C。
(2)氯元素的化合价从0价降低到-1价,得到1个电子。氮元素化合价从-3价升高到0价,失去3个电子,因此根据电子得失守恒可知氧化剂和还原剂的物质的量之比是3∶2,根据原子守恒可知还有水生成,因此反应的化学方程式为2KOCN+3Cl2+8KOH===2K2CO3+N2+6KCl+4H2O;正确答案:2 3 8 KOH 2 1 6 4 H2O。
(3)根据以上分析可知1 mol KCN最终被氧化为碳酸钾和氮气,失去5 mol电子,1氯气得到2 mol电子,根据电子得失守恒可知将10 L含KCN的浓度为0.01 mol·L-1的废水中KCN氧化除去,最少需要氯气![]() =0.25 mol;正确答案:0.25。
=0.25 mol;正确答案:0.25。
(4)没有480 mL规格的容量瓶,所以还需500 mL容量瓶;正确答案:500 mL容量瓶。
(5)Na2S2O3被氯气氧化为SO![]() ,Cl2被还原为Cl-,根据电子守恒、离子守恒、原子守恒写出该反应为:S2O
,Cl2被还原为Cl-,根据电子守恒、离子守恒、原子守恒写出该反应为:S2O![]() +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO![]() +8Cl-+10H+;正确答案:S2O
+8Cl-+10H+;正确答案:S2O![]() +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO![]() +8Cl-+10H+。
+8Cl-+10H+。

 名校课堂系列答案
名校课堂系列答案【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4![]() HBr+NaHSO4①
HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/(g·cm-3) | 0.7893 | 1.4612 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.3 |
请回答下列问题。
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
A 圆底烧瓶 B 量筒 C 锥形瓶 D 漏斗
(2)溴代烷的水溶性________(填“大于”“等于”或“小于”)相应的醇,其原因是____________。
(3)将1-溴丁烷粗产品置于分液漏斗中,加水振荡后静置,产物在________(填“上层”或“下层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填序号)。
A 减少副产物烯和醚的生成 B 减少Br2的生成
C 减少HBr的挥发 D 使水作为反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质最合适的是__________(填序号)。
A NaI B NaOH C NaHSO3 D KCl
(6)在制备溴乙烷时,采用边反应边蒸馏产物的方法,其有利于_________;但在制备1-溴丁烷时却不能边反应边蒸馏,其原因是___________。