题目内容
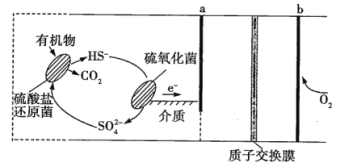
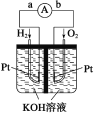
【题目】中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池方面获得新突破,研制出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。(已知:质子交换膜的作用是只允许H+通过;甲醇在氧气中燃烧生成CO2和H2O。)

(1)该电池工作时,b处通入的物质为__,c处通入的物质为___。
(2)该电池负极的电极反应式为__。
(3)该电池工作一段时间后,当12.8g甲醇完全反应时,有___mol电子发生转移。
【答案】CH3OH O2(或空气) CH3OH-6e-+H2O=CO2↑+6H+ 2.4
【解析】
甲醇燃料电池,甲醇在负极发生氧化反应,氧气在正极发生还原反应,根据阳离子向正极移动规律可推知右侧为原电池的正极;根据两极反应规律写出极反应,并据此计算电子转移的量。
(1)根据图中氢离子的移动方向可判断出右侧电极是正极,正极上氧气得电子,左侧电极是负极,负极通入燃料甲醇。
答案为:CH3OH;O2(或空气)。
(2)乙醇发生氧化反应,在负极放电,总反应式为:2CH3OH+3O2=2CO2+4H2O,正极反应式为:3O2+12H++12 e-=6H2O,两式相减可得负极的电极反应式: CH3OH-6e-+H2O=CO2+6H+。
答案为:CH3OH-6e-+H2O=CO2+6H+。
(3)12.8g甲醇完全转化为二氧化碳时,根据CH3OH-6e-+H2O=CO2+6H+可以计算出转移电子的物质的量=![]() =2.4mol。
=2.4mol。
答案为:2.4。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目