题目内容
【题目】为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法不正确的是( )
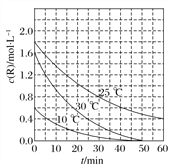
A. 25 ℃时,在0~30 min内,R的分解平均速度为0.033 mol·L-1·min-1
B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等
C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大
D. 对比30 ℃和10 ℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
【答案】D
【解析】A. 25 ℃时,在0~30 min内,R的分解平均速度为[(1.8-0.8)/30]mol·L-1·min-1=0.033 mol·L-1·min-1,故A正确;B. 对比30 ℃和10 ℃曲线,在50 min时,R的分解百分率相等,故B正确;C. 对比30 ℃和25 ℃曲线,在0~50 min内,能说明R的分解平均速度随温度升高而增大,故C正确;D. 对比30 ℃和10 ℃曲线,在同一时刻,两曲线R的浓度不同,不能说明R的分解速率随温度升高而增大,故D不正确。故选D。

【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Cu2+ Na+ |
阴离子 | NO3- SO42- Cl- |
下图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了32g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图2所示。据此回答下列问题:
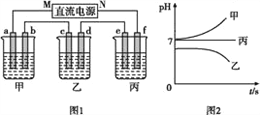
(1)M为电源的__________极(填“正”或“负”);
(2)写出甲烧杯中反应的化学方程式____________________;
(3)计算电极f上生成的气体在标准状况下的体积_____________。