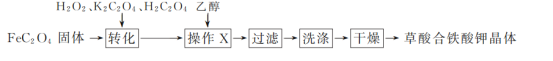
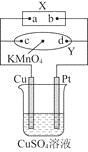
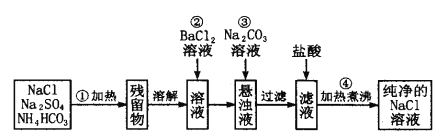
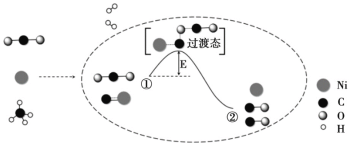
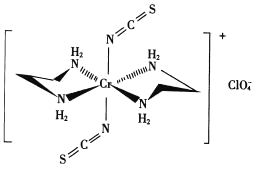
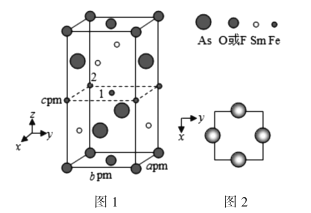
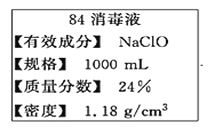
题目内容
【题目】氢化铝锂(LiAlH4)以其优良的还原性能在医药、香料、农药、染料等行业中广泛应用。纯氢化铝锂是一种白色晶状固体,熔点 125℃,加热至 130℃时分解,溶于醚、四氢呋喃,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应。目前世界上有四种工业生产 LiAlH4的方法,其中施莱兴格(Schlesinger)法和高压合成法最为常见。
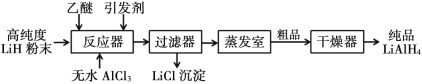
Ⅰ. 施莱兴格(Schlesinger)法
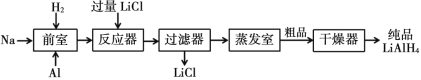
Ⅱ.高压合成法
请根据题中信息回答以下问题:
(1)Schlesinger 中的反应器需要附加电磁搅拌器,目的是________。
(2)Schlesinger 的反应器中发生的化学反应方程式是________。
(3)采用 Schlesinger 时需要使用大量高纯度氩气,氩气的作用是________。
(4)为了降低成本,在 Schlesinger 工艺中有一种原料可以循环使用,这种原料是________。
(5)已知乙醚沸点为 35℃,某工厂准备在蒸发室采用减压蒸发分离出产品,你认为有无必要,请简述理由________。
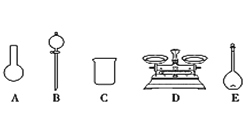
(6)两种工艺均使用过滤器,中学实验室中过滤装置需要的玻璃仪器有________。
(7)使用氢化铝锂要注意安全, 少量未反应完的需要分解处理。其中一种处理方法是向其中缓慢加入适量的稀盐酸,待无气体放出后视为处理完全。请写出此过程的化学反应方程式______________________________________。
【答案】加快反应速率,使反应更充分 4LiH+AlCl3=LiAlH4+3LiCl 保护气,排出设备中的空气和水蒸气 乙醚 无必要,乙醚沸点远低于LiAlH4的分解温度,直接加热蒸发即可分离 烧杯、漏斗、玻璃棒 LiAlH4+4HCl=LiCl+AlCl3+4H2↑
【解析】
纯氢化铝锂的熔点 125℃,加热至 130℃时分解,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应。根据施莱兴格(Schlesinger)法和高压合成法生产LiAlH4的流程,结合化学实验的基本操作和方法分析解答。
(1)Schlesinger 中的反应器中附加电磁搅拌器,可以增大反应物的接触面积,加快反应速率,使反应更充分,故答案为:加快反应速率,使反应更充分;
(2)根据流程图,Schlesinger 的反应器中高纯度LiH粉末和无水AlCl3反应生成LiAlH4和LiCl,反应的化学反应方程式为4LiH+AlCl3=LiAlH4+3LiCl,故答案为:4LiH+AlCl3=LiAlH4+3LiCl;
(3) 纯氢化铝锂在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应,采用 Schlesinger 时需要使用大量高纯度氩气,氩气性质稳定,可以用作保护气,排出设备中的空气和水蒸气,防止氢化铝锂遇水爆炸,故答案为:保护气,排出设备中的空气和水蒸气;
(4)根据流程图,蒸发室中蒸发出来的物质中含有乙醚,为了降低成本,在 Schlesinger 工艺中乙醚可以循环使用,故答案为:乙醚;
(5)乙醚沸点为 35℃,远低于LiAlH4的分解温度(130℃),因此在蒸发室没有必要采用减压蒸发,故答案为:无必要,乙醚沸点远低于LiAlH4的分解温度,直接加热蒸发即可分离;
(6)两种工艺均使用过滤器,中学实验室中过滤装置需要的玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:烧杯、漏斗、玻璃棒;
(7) 氢化铝锂加热至 130℃时分解,在 120℃以下和干燥的空气中相对稳定,但遇水即爆炸性反应,使用氢化铝锂要注意安全,少量未反应完的氢化铝锂需要及时处理。其中一种处理方法是向其中缓慢加入适量的稀盐酸,待无气体放出后视为处理完全,氢化铝锂与盐酸反应放出氢气,反应的化学反应方程式为LiAlH4+4HCl=LiCl+AlCl3+4H2↑,故答案为:LiAlH4+4HCl=LiCl+AlCl3+4H2↑。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案