题目内容
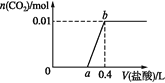
【题目】已知:还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。
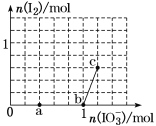
下列说法正确的是( )
A.0~b间的反应可用离子方程式3SO32-+IO3-=3SO42-+I-表示
B.a点时消耗的NaHSO3的物质的量为1.2 mol
C.b点到c点,KIO3与NaHSO3反应生成I2
D.当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.08 mol
【答案】B
【解析】
A.根据还原性HSO3>I,氧化性IO3> I2,o~b, IO3氧化HSO3-生成I、SO42、H+,离子方程式为:3HSO3-+ IO3-= 3SO42-+ I-+ 3H+,A项错误;
B.a点n(IO3)=0.4mol,根据离子方程式可得:n(NaHSO4)=3n(IO3)=3×0.4mol=1.2mol,B项正确;
C.b~c段,IO3氧化I生成I2,反应为IO3+5I+6H+=3I2+3H2O,C项错误;
D.氧化HSO3需要KIO3:1/3×3mol=1mol,生成I1mol,设氧化I的IO3为nmol,根据离子方程式可得氧化I的物质的量为5n mol,生成的I2物质的量为3n mol,则(1-5n):3n=5:3,得n=0.1mol,所以加入的KIO3共1.1mol,D项错误。
故答案选B。

练习册系列答案
相关题目