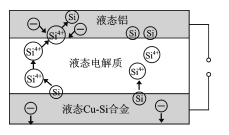
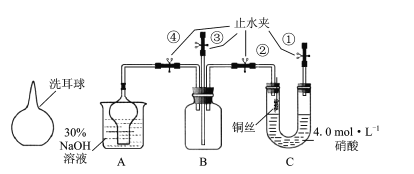
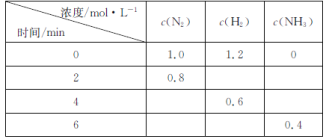
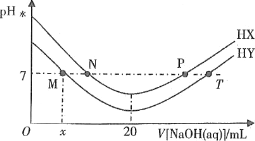
题目内容
【题目】某无机盐X(仅含三种元素,原子个数比为1:1:4,摩尔质量270g·mol-1),为探究其组成和性质,某学习小组进行了如下实验,X与水反应只生成A、B两种物质,其中气体单质 A 能使带火星的木条复燃。下列说法正确的是:

(1)X的组成元素为 O和_____________(用元素符号表示)。
(2)X 的 化学式为____________。
(3)下列说法正确的是(NA为阿伏加德罗常数)_________ 。
a.酸式盐B的焰色反应颜色可以直接观察
b.盐X中的两种非金属元素所组成的氧化物都能使酸性高锰酸钾溶液褪色
c.1摩尔的固体B中含2NA个离子
d.氮气和气体单质A点燃即可发生反应
(4)X氧化能力极强,可用于脱硫脱硝,写出在碱性条件下X氧化SO32-的离子方程式____________。
【答案】K 、 S K2S2O8 C S2O8 2-+ SO32-+2OH-=3SO42-+ H2O
【解析】
单质 A 能使带火星的木条复燃,则A为O2,B焰色反应呈紫色,则含有K元素,B的酸性溶液与BaCl2反应产生白色沉淀,则B中含有SO42-,27gX物质的量为0.1mol,S元素物质的量![]() ,则S原子个数为
,则S原子个数为![]() ,结合摩尔质量和原子个数比推出分子式。
,结合摩尔质量和原子个数比推出分子式。
单质 A 能使带火星的木条复燃,则A为O2,B焰色反应呈紫色,则含有K元素,B的酸性溶液与BaCl2反应产生白色沉淀,则B中含有SO42-,27gX物质的量为0.1mol,S元素物质的量![]() ,则S原子个数为
,则S原子个数为![]() ,原子个数比为1:1:4,摩尔质量270g·mol-1,则化学式为K2S2O8,
,原子个数比为1:1:4,摩尔质量270g·mol-1,则化学式为K2S2O8,
(1)X的组成元素为 O和K 、 S,
故答案为:K 、 S;
(2)由上述推断可知X 的化学式为K2S2O8,
故答案为:K2S2O8;
(3)a.K的焰色反应需透过蓝色钴玻璃片观察,故a错误;
b.盐X中的两种非金属元素所组成的氧化物有SO2、SO3、H2O、H2O2;SO2和H2O2能使酸性高锰酸钾溶液褪色,SO3和H2O不能使酸性高锰酸钾溶液褪色,故b错误;
c. B为酸性溶液则B为KHSO4,固体B中含有K+和HSO4-离子,故1摩尔的固体B中含2NA个离子,故c正确;
d.氮气和O2不可点燃,故d错误 ;
故答案选:c;
(4)X氧化SO32-X为氧化剂,SO32-为还原剂,根据化合价升降守恒可得离子方程式为:![]() ,
,
故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
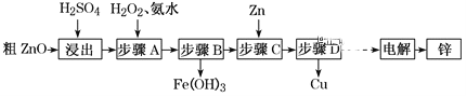
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,常将粗氧化锌粉碎成细颗粒,适当增加硫酸的浓度,目的是_________。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2 Zn(OH)2 ,该步骤需控制溶液pH的范围是____________,该步骤中先加入H2O2充分反应后再加入氨水,写出加入H2O2的离子方程式_____________。
(3)步骤C的反应离子方程式为____________。
(4)若步骤A中加入H2O2后,室温下将溶液的pH调为4,求Fe3+ 离子浓度为_________。(已知Ksp[Fe(OH)3]= 4.0×10-3 8)