题目内容
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
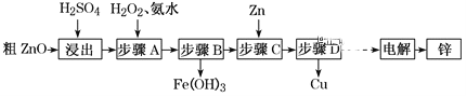
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,常将粗氧化锌粉碎成细颗粒,适当增加硫酸的浓度,目的是_________。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2 Zn(OH)2 ,该步骤需控制溶液pH的范围是____________,该步骤中先加入H2O2充分反应后再加入氨水,写出加入H2O2的离子方程式_____________。
(3)步骤C的反应离子方程式为____________。
(4)若步骤A中加入H2O2后,室温下将溶液的pH调为4,求Fe3+ 离子浓度为_________。(已知Ksp[Fe(OH)3]= 4.0×10-3 8)
【答案】加快反应速率 3. 2≤pH<5.2 2Fe2++H2O2+2H+=2Fe3++2H2O Cu2+ + Zn = Zn2+ + Cu 4 ×10-8
【解析】
(1)根据影响化学反应速率的因素,酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有将粗氧化锌粉碎成细颗粒、适当增加硫酸的浓度、适当升高温度等,故目的是加快反应速率;
(2)氢氧化铁沉淀时的pH是1.48 ~ 3.2 ,Zn(OH)2沉淀时的pH为6.2 ~ 8.0,和Cu(OH)2沉淀时的pH为5.2~6.4,因此将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2 ,该步骤需控制溶液pH的范围为3.2<pH<5.2,加入H2O2 ,发生过氧化氢氧化亚铁离子的反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)步骤C中加入锌,发生锌和硫酸铜反应生成铜和硫酸锌,反应离子方程式为Cu2++Zn=Zn2++Cu;
(4) 若步骤A中加入H2O2后,室温下将溶液的pH调为4,c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]= c(Fe3+)c3(OH-)= c(Fe3+)× (10-10mol/L) 3=4.0×10-38,故c(Fe3+)=4.0×10-8 mol/L。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案