题目内容
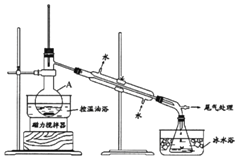
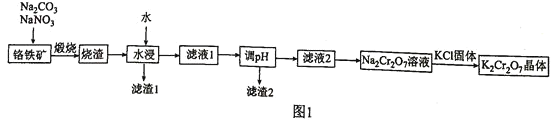
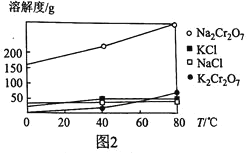
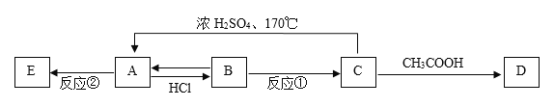
【题目】合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g) △H<0。一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达 到平衡,测得容器中CO2的浓度为0.05molL-1 。
CO(NH2)2(s)+H2O(g) △H<0。一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达 到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.气体的平均相对分子质量不随时间而变化 b.NH3和CO2的比例保持不变
c.气体的压强不再发生变化 d.2υ正(NH3)=υ逆(H2O)
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.24000kPa b.200℃ c.800℃ d.101 kPa
【答案】0.02 molL-1min-1 ac a b
【解析】
(1)根据已知信息,计算平衡时氨气的转化量,再根据公式![]() 计算速率;
计算速率;
(2)根据化学平衡状态的特征判断,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)根据影响平衡移动的因素进行分析。
(1)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中CO2的浓度为0.05mol·L-1,则消耗0.5molCO2、1molNH3,则氨气的反应速率为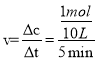 =0.02molL-1min-1;
=0.02molL-1min-1;
(2)a.反应前后气体的物质的量不等,气体的平均相对分子质量不随时间而变化,可说明达到平衡状态,故a正确;
b.充入2mol NH3和1mol CO2,且按2:1反应,则无论是否达到平衡状态,NH3和CO2的比例都保持不变,故b错误;
c.反应前后气体体积不等,则气体的压强不再发生变化,可说明达到平衡状态,故c正确;
d.2υ正(NH3)=υ逆(H2O),正逆反应速率不等,没有达到平衡状态,故d错误;
故选:ac;
(3)为提高氨气的转化率,采用使得化学平衡正向移动的措施即可,工业上用该反应生产尿素时,合适的反应条件是高温高压,
故选:a b。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案