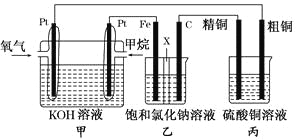
题目内容
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下:
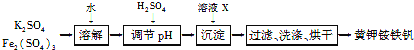
(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g,则黄钾铵铁矾的化学式为______________。
【答案】氨水(或NH3·H2O) 用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+ KNH4Fe6(SO4)4(OH)12
【解析】
(1)由制取黄钾铵铁矾的流程图及黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]的组成可知,加入X是氨水,以便生成黄钾铵铁矾;
(2)通过焰色反应检验钾离子的存在情况,方法为:用洁净的铂丝(或铁丝)蘸取滤液在酒精灯火焰上灼烧,透过蓝色的钴玻璃观察,若火焰呈紫色,则存在K+;
(3)②的沉淀为硫酸钡,硫酸钡的物质的量等于溶液中硫酸根的物质的量:n(SO42-)=n(BaSO4)=![]() =0.04 mol;
=0.04 mol;
③所得气体为氨气,溶液中铵根离子物质的量等于氨气的物质的量:n(NH4+)=n(NH3)=![]() =0.01 mol;
=0.01 mol;
④最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2×![]() =0.06 mol,黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中,n(K+)=n(NH4+)=0.01mol,根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12 mol,n(K+):n(NH4+):n(Fe3+):n(SO42-):n(OH-)=1:1:6:4:12,黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12。
=0.06 mol,黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中,n(K+)=n(NH4+)=0.01mol,根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12 mol,n(K+):n(NH4+):n(Fe3+):n(SO42-):n(OH-)=1:1:6:4:12,黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12。

【题目】某兴趣小组制备氢氧化亚铁沉淀。
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
(1)实验1中产生白色沉淀的离子方程式是_______。
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是______。
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种灰绿色氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入________,再往试管中加入_________,振荡,现象与实验1相同,结论是该假设不成立。
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10mLNaOH溶液 | 滴加FeSO4溶液 | 实验现象 | |
实验2 | 6 mol/LNaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6 mol/LNaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是________。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是__________,证明该假设成立。
(3)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件_____。
(4)下列情况会导致所配NaOH溶液的浓度偏高的是_______。
A.NaOH溶液未冷却至室温就进行定容 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D