题目内容
7.超级储能可充电氟镁动力电池性能比电池优良,其工作原理如图所示,电池总反应为Mg+2MnF3═2MnF2+MgF2.下列有关说法正确的是( )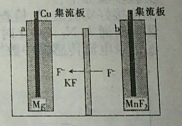
| A. | b为负极 | |
| B. | 该电池放电时,Cu集流板上Cu失电子 | |
| C. | 充电时,F-通过交换膜从b极区移向a极区 | |
| D. | 充电时,阳极的电极反应式为2MnF2+2F--2e-═2MnF3 |
分析 根据电池总反应为Mg+2MnF3═2MnF2+MgF2分析,镁做负极,发生氧化反应为Mg-2e-=Mg2+,而MnF3作正极,发生还原反应为;2MnF3+2e-=2MnF2+2F-;充电时,镁与电源负极相连作阴极,发生还原反应,MnF3与电源正极相连作阳极,发生氧化反应,据此分析.
解答 解:根据电池总反应为Mg+2MnF3═2MnF2+MgF2分析,镁做负极,发生氧化反应为Mg-2e-=Mg2+,而MnF3作正极,发生还原反应为;2MnF3+2e-=2MnF2+2F-;充电时,镁与电源负极相连作阴极,发生还原反应,MnF3与电源正极相连作阳极,发生氧化反应,
A、依据原电池原理分析可知,镁做负极,MnF3作正极,则b为正极,故A错误;
B、依据原电池原理分析可知,镁做负极,发生氧化反应为Mg-2e-=Mg2+,故B错误;
C、充电时,镁与电源负极相连作阴极即a为阴极,发生还原反应,MnF3与电源正极相连作阳极即b为阳极,发生氧化反应,所以F-通过交换膜从阴极a极区移向阳极b极区,故C错误;
D、充电时,镁与电源负极相连作阴极即a为阴极,发生还原反应,MnF3与电源正极相连作阳极即b为阳极,发生氧化反应,反应为2MnF2+2F--2e-═2MnF3,故D正确;
故选D.
点评 本题考查化学电源新型电池,题目难度中等,本题注意根据电池总反应式正确判断电极反应,并能书写电极反应式是解答该题的关键.

练习册系列答案
相关题目
17.下列各组反应,前后均可以用同一个离子方程式表示的是( )
| A. | HCl+Na2CO3═HCl+NaHCO3 | B. | HCl+Na2CO3═H2SO4+K2CO3 | ||
| C. | H2S+NaOH═H2SO4+KOH | D. | BaCl2+Na2SO4═BaCO3+H2SO4 |
18.将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
| A. | 231.5mL | B. | 268.8mL | C. | 282.5mL | D. | 313.6mL |
19.将Na2O2、Al2O3两种物质同时置于水中,待固体溶解后,向所得溶液中通入一定量HCl气体,所得溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )
| A. | 3:2:1 | B. | 2:4:1 | C. | 2:3:1 | D. | 4:2:1 |
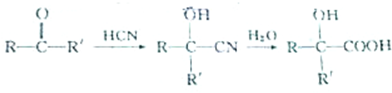 产物分子比原化合物分子多出一个碳原子,增长了碳链.
产物分子比原化合物分子多出一个碳原子,增长了碳链.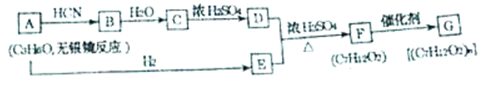
 .
.