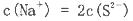题目内容
(原创)向100mL 0.1mol/L醋酸溶液中加入下列物质,混合溶液有关量或性质变化趋势正确的是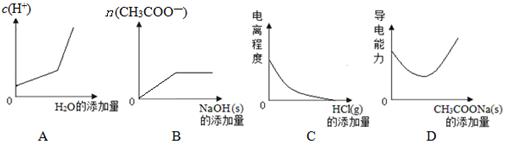
B
解析试题分析:A、向100mL 0.1mol/L醋酸溶液中加入H2O,H+浓度逐渐减小,图像错误;B、向100mL 0.1mol/L醋酸溶液中加入NaOH固体,CH3COOH与NaOH反应生成CH3COONa,CH3COO?浓度增大,完全反应后,再加入NaOH固体,CH3COO?浓度不变,图像正确;C、加入HCl,抑制CH3COOH的电离,但电离程度不可能变为0,图像错误;D、加入CH3COONa固体,离子浓度总和不断增大,导电能力不断增强,图像错误。
考点:本题考查弱电解质的电离平衡。

练习册系列答案
相关题目
某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
| 实验编号 | KClO3(g) | 氧化物 | 产生气体(mL)(已折算为标况) | 耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | — | — | — | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为 。
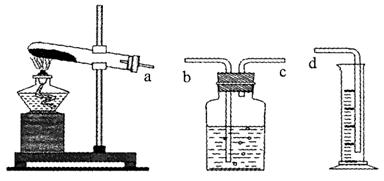
(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2的质量,实验的操作顺序是:溶解→ 。
(3)写出实验室中通过编号2制取氧气的化学方程式:
(4)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 (填物质的化学式)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是 (填化学式),可用 试纸检验该气体,上述异常现象产生的原因是 。
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
| A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+c (C2O42-) =" 0.1" mol·L-1 |
| C.c(C2O42-) < c(H2C2O4) |
| D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
已知25 ℃时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到KI溶液中,AgCl转化为AgI,因为AgCl溶解度大于AgI |
NH4Cl溶液中的离子浓度大小关系正确的是
A. | B. |
C.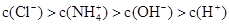 | D. |
25℃时,水中存在电离平衡:

 。下列叙述正确的是
。下列叙述正确的是
A.将水加热, 增大, 增大, 不变 不变 |
B.向水中加入少量NaHSO4固体,c(H+)增大, 不变 不变 |
C.向水中加入少量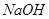 固体,平衡逆向移动, 固体,平衡逆向移动, 降低 降低 |
D.向水中加入少量 固体,平衡正向移动, 固体,平衡正向移动, 增大 增大 |
下列说法正确的是 ( )
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C.物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |
已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是
| A.c(K+)+ c(H+) =c(HSO3-)+ c(OH-)+ c(SO32-) |
| B.c(HSO3-) + c(SO32-) = 0.1mol·L-1 |
| C.c(SO32-) < c(H2SO3) |
| D.c(K+) = c(H2SO3) + c(HSO3-) + c(SO32-) |