题目内容
阿伏加德罗常数约为6.02×1023mol-1.下列叙述中正确的是( )
| A、32g含有少量臭氧的氧气中,共含有氧原子数为2×6.02×1023 |
B、32g S8单质中含有的S-S键个数为2NA(S8分子模型如图) |
| C、5.6g铁粉完全溶于硝酸,失去的电子数介于0.2×6.02×1023~0.3×6.02×1023之间 |
| D、在SiO2晶体中,若含有1mol Si原子,则含Si-O键数为2×6.02×1023 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氧气和臭氧都是由氧元素组成,依据m=
计算32g混合物含O的物质的量;
B.S8分子是皇冠形,上面4个硫,下面4个硫,依次连成键,一个S8分子中含8个S-S键据此解答;
C.铁和硝酸反应生成三价铁或二价铁,依据氧化还原反应的电子守恒计算;
D.依据二氧化硅中1个硅原子形成四个硅氧键解答.
| m |
| M |
B.S8分子是皇冠形,上面4个硫,下面4个硫,依次连成键,一个S8分子中含8个S-S键据此解答;
C.铁和硝酸反应生成三价铁或二价铁,依据氧化还原反应的电子守恒计算;
D.依据二氧化硅中1个硅原子形成四个硅氧键解答.
解答:
解:A.氧气和臭氧都是由氧元素组成,32g混合物含O的物质的量=
=2mol,所以共含有氧原子数为2×6.02×1023,故A正确;
B.S8分子是皇冠形,上面4个硫,下面4个硫,依次连成键,一个S8分子中含8个S-S键,则32gS8含有的S-S键个数为
×8×NA=NA,故B错误;
C.6g铁粉完全溶于硝酸,生成三价铁离子失电子0.3mol,生成二价铁离子失电子0.2mol,所以失去的电子数介于0.2×6.02×1023~0.3×6.02×1023之间,故C正确;
D.1个硅原子形成四个硅氧键,在SiO2晶体中,若含有1mol Si原子,则含Si-O键数为4×6.02×1023,故D错误;
故选:AC.
| 32g |
| 16g/mol |
B.S8分子是皇冠形,上面4个硫,下面4个硫,依次连成键,一个S8分子中含8个S-S键,则32gS8含有的S-S键个数为
| 32g |
| 256g/mol |
C.6g铁粉完全溶于硝酸,生成三价铁离子失电子0.3mol,生成二价铁离子失电子0.2mol,所以失去的电子数介于0.2×6.02×1023~0.3×6.02×1023之间,故C正确;
D.1个硅原子形成四个硅氧键,在SiO2晶体中,若含有1mol Si原子,则含Si-O键数为4×6.02×1023,故D错误;
故选:AC.
点评:本题考查了阿伏伽德罗常数的应用,主要考查物质构成,浓度和物质的量的换算,氧化还原反应电子守恒计算,二氧化硅结构分析,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列灭火剂能用于扑灭金属钠着火的是( )
| A、干冰灭火剂 |
| B、黄砂 |
| C、干粉(含NaHCO3)灭火剂 |
| D、泡沫灭火剂 |
下述说法中合理的是( )
| A、SO2通入Ba(NO3)2溶液中得到BaSO3沉淀 |
| B、Cl2和SO2等体积充分混合后,通入品红溶液,品红褪色速率更快 |
| C、NO2和SO2都是形成酸雨的气体 |
| D、某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化(其中m≠n,且均为正整数).下列说法正确的是( )


| A、X、Y不可能均为非金属元素 |
| B、若X为Fe,Y只能为Cl |
| C、X一定为金属元素 |
| D、若X为Fe.Y可为Cl、Br,但不能是I |
下列叙述正确的是( )
| A、纤维素、淀粉和蛋白质都是高分子化合物 |
| B、食盐、醋酸和蔗糖都是电解质 |
| C、甲烷和乙烯均可使酸性KMnO4溶液褪色 |
| D、乙酸乙酯和植物油均可水解生成乙醇 |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法不正确的是( )
| 180℃ |
| 催化剂 |
| A、每转化掉1mol NO和1mol NO2混合气体,反应转移6mol电子 |
| B、升高温度,可使该反应的反应速率增大 |
| C、平衡时,其他条件不变,升高温度则该反应的平衡常数减少 |
| D、其他条件不变,使用高效催化剂平衡会发生移动,氮氧化物的转化率增大 |
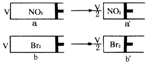 两个体积相同带活塞的容器,分别盛装一定量的NO2和Br2(g),都为一样的红棕色,迅速将两容器同时压缩到原来的一半(如图)假设气体不液化,则下列说法正确的是( )
两个体积相同带活塞的容器,分别盛装一定量的NO2和Br2(g),都为一样的红棕色,迅速将两容器同时压缩到原来的一半(如图)假设气体不液化,则下列说法正确的是( )| A、a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅 |
| B、a′,b′的颜色一样深 |
| C、a′的压强比a的压强2倍要小,b′的压强为b的压强的2倍 |
| D、a′中的c(NO2)一定比b′中的c(Br2 )小 |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、8g甲烷含有的共价键数约为NA |
| B、常温常压下,22.4L二氧化碳原子总数为3NA |
| C、2.8g铁粉与足量稀硝酸反应,转移0.15NA个电子 |
D、 3.2g硫(结构见图)含S-S键的数目为0.8NA 3.2g硫(结构见图)含S-S键的数目为0.8NA |
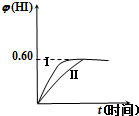 将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数φ(HI) 随时间的变化如曲线(Ⅱ)所示.
将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数φ(HI) 随时间的变化如曲线(Ⅱ)所示.