题目内容
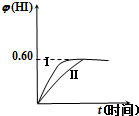 将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数φ(HI) 随时间的变化如曲线(Ⅱ)所示.
将1mol I2(g)和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数φ(HI) 随时间的变化如曲线(Ⅱ)所示.(1)达到平衡后,I2(g)的物质的量浓度为
(2)若改变反应条件,φ(HI)的变化过程如曲线(Ⅰ)所示,则该条件可能是
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当的催化剂.
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:(1)根据原子守恒计算碘的物质的量浓度;
(2)该反应是一个反应前后气体体积不变的可逆反应,改变条件时,该反应中HI的体积分数不变,说明改变体积平衡不移动,改变条件时到达平衡的时间缩短,说明加快反应速率,改变的条件可能是增大压强、加入催化剂.
(2)该反应是一个反应前后气体体积不变的可逆反应,改变条件时,该反应中HI的体积分数不变,说明改变体积平衡不移动,改变条件时到达平衡的时间缩短,说明加快反应速率,改变的条件可能是增大压强、加入催化剂.
解答:
解:(1)碘的初始浓度=
=0.5mol/L,该反应前后气体体积不变,平衡时,HI的体积分数为0.6,则n(HI)
=3mol×0.6=1.8mol,C(HI)=
=0.9mol/L,根据I原子守恒得C(HI)+2C(I2)=0.5mol/L×2,C(I2)=
mol/L=0.05mol?L-1,故答案为:0.05mol?L-1;
(2)该反应是一个反应前后气体体积不变的可逆反应,改变条件时,该反应中HI的体积分数不变,说明改变体积平衡不移动,改变条件时到达平衡的时间缩短,说明加快反应速率,改变的条件可能是增大压强、加入催化剂,故选③⑤.
| 1mol |
| 2L |
=3mol×0.6=1.8mol,C(HI)=
| 1.8mol |
| 2L |
| 1-0.9 |
| 2 |
(2)该反应是一个反应前后气体体积不变的可逆反应,改变条件时,该反应中HI的体积分数不变,说明改变体积平衡不移动,改变条件时到达平衡的时间缩短,说明加快反应速率,改变的条件可能是增大压强、加入催化剂,故选③⑤.
点评:本题考查了物质的量浓度、外界条件对化学反应平衡移动的影响等知识点,根据原子守恒计算平衡时碘的浓度,再结合图象中反应时间、HI的体积分数确定改变条件,注意:无论放热反应还是吸热反应,温度都改变化学平衡移动,为易错点.

练习册系列答案
相关题目
阿伏加德罗常数约为6.02×1023mol-1.下列叙述中正确的是( )
| A、32g含有少量臭氧的氧气中,共含有氧原子数为2×6.02×1023 |
B、32g S8单质中含有的S-S键个数为2NA(S8分子模型如图) |
| C、5.6g铁粉完全溶于硝酸,失去的电子数介于0.2×6.02×1023~0.3×6.02×1023之间 |
| D、在SiO2晶体中,若含有1mol Si原子,则含Si-O键数为2×6.02×1023 |
对下列化学用语的理解和描述不正确的是( )
A、原子结构示意图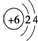 可以表示12C原子的,也可以表示14C原子的 可以表示12C原子的,也可以表示14C原子的 |
B、比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、结构示意图为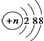 的阳离子都不能破坏水的电离平衡 的阳离子都不能破坏水的电离平衡 |
D、电子式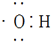 可以表示羟基,不可以表示氢氧根离子 可以表示羟基,不可以表示氢氧根离子 |
下列有关氕(H)、氘(D)、氚(T)的说法正确的是( )
| A、是三种不同的元素 |
| B、H元素平均的相对原子质量=(1+2+3)÷3 |
| C、通常我们把氢的相对原子质量当1来计算,这是以氕的相对原子质量为标准计算的 |
| D、自然界中所有含氢物质中都含有氕、氘、氚三种核素 |
下列根据反应原理设计的实际应用不正确的是( )
| A、CO32-+H2O?HCO3-+OH-;用热的纯碱溶液清洗油污 |
| B、SnCl2+H2O?Sn(OH)Cl+HCl;配制氯化亚锡溶液时加入氢氧化钠溶液 |
| C、A13++3HCO3-═Al(OH)3↓+3CO2↑;泡沫灭火器灭火 |
| D、A13++3H2O?Al(OH)3(胶体)+3H+;明矾净水 |
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.