题目内容
【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一.
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:
①C(s)+O2 (g)=CO2 (g)△H=﹣393.5kJmol﹣1
②CO(g)+ ![]() O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
③H2(g)+ ![]() O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 , 该反应的化学平衡常数K随温度的升高将(填“增大”、“减小”或“不变”).
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)CO2(g)+H2(g)△H<0.在甲、乙两个恒容密闭容器中,起始时按照表数据进行投料,在800℃时达到平衡状态,K=1.0.
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 .
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2 , 负极通入CO,电解质是熔融碳酸钠,写出工作时正极的电极反应式: , 若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下)L.
(4)将(2)中生成的混合气用过量的NaOH溶液吸收,得到的溶液中有一种溶质可以水解,请写出其水解的离子方程式: , .
【答案】
(1)C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;增大
(2)逆反应;50%
(3)O2+4e﹣+2CO2=2CO32﹣;6.72
(4)CO32﹣+H2O?HCO3﹣+OH﹣;HCO3﹣+H2O?H2CO3+OH﹣
【解析】解:(1)在25℃、101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为:H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8 kJ/mol,
O2(g)═H2O(g)△H=﹣241.8 kJ/mol,
已知:①C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
②CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJ/mol
O2(g)═CO2(g)△H=﹣283.0kJ/mol
③H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8 kJ/mol,
O2(g)═H2O(g)△H=﹣241.8 kJ/mol,
根据盖斯定律,①﹣③﹣②得C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1 , 由于该反应为吸热反应,所以升高温度平衡正移,K增大;
所以答案是:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;增大;(2)甲容器中:Qc= ![]() =
= ![]() =
= ![]() >1=K,所以反应向逆反应进行;
>1=K,所以反应向逆反应进行;
令参加反应的CO的物质的量为nmol,则:
CO(g)+ | H2O(g) | CO2(g)+ | H2(g) | ||
开始(mol): | 0.1 | 0.1 | 0 | 0 | |
变化(mol): | n | n | n | n | |
平衡(mol): | 0.1-n | 0.1-n | n | n |
由于反应前后气体的体积不变,可以用物质的量代替浓度计算平衡常数,故 ![]() =1,解得n=0.05,故CO的转化率为
=1,解得n=0.05,故CO的转化率为 ![]() ×100%=50%,
×100%=50%,
所以答案是:逆反应;50%;(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2 , 负极通入CO,电解质是熔融碳酸盐,依据原电池反应原理可知负极是一氧化碳失电子发生氧化反应生成二氧化碳的过程,正极上氧气得到电子被还原,与二氧化碳反应生成CO32﹣ , 电极方程式为:O2+4e﹣+2CO2=2 CO32﹣;
若使用该电池电解熔融Al2O3制取10.8g Al,结合电解反应化学方程式计算,2Al2O3 ![]() 4Al+3O2↑;n(Al)=
4Al+3O2↑;n(Al)= ![]() =0.4mol
=0.4mol
依据电子守恒得到:O2~4e﹣~ ![]() Al,
Al,
则理论上需要氧气物质的量为0.3mol,氧气的体积为(标准状况下) 6.72L,
所以答案是:O2+4e﹣+2CO2=2 CO32﹣;6.72(4)因(2)中生成的混合气含有CO2 , 用过量的NaOH溶液吸收生成Na2CO3 , 为强碱弱酸盐,水解呈碱性,离子方程式为CO32﹣+H2OHCO3﹣+OH﹣ , HCO3﹣+H2OH2CO3+OH﹣ ,
所以答案是:CO32﹣H2OHCO3﹣+OH﹣、HCO3﹣+H2OH2CO3+OH﹣ .
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A= , C= , E=
实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | A | B | C | 30 | t2 |
③ | 常温 | 2 | 40 | D | E | t3 |
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是 .
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是: 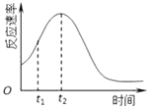
①;②
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:;实验中所需的定量仪器有(填仪器名称).该KMnO4溶液的物质的量浓度为mol/L.
【题目】材料与化学密切相关,表中对应关系错误的是
选项 | 材料 | 主要化学成分 |
A | 普通水泥、普通玻璃 | 硅酸盐 |
B | 刚玉、金刚石 | 三氧化二铝 |
C | 天然气、可燃冰 | 甲烷 |
D | 光导纤维、石英 | 二氧化硅 |
A. A B. B C. C D. D