题目内容
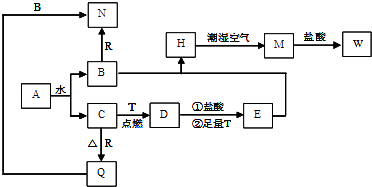
【题目】把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是( )
A.3.4mol/L
B.0.2mol/L
C.1.8mol/L
D.3.6mol/L
【答案】A
【解析】解:标况下2.24L混合气体的物质的量为: ![]() =0.1mol,
=0.1mol,
2.016LO2的物质的量为:n(O2)= ![]() =0.09mol,则:
=0.09mol,则:
2Na2O2+ | 2CO2 | =2Na2CO3+O2 | 气体物质的量减小△n |
2 | 2 | 2 | |
n(CO2) | 0.1mol﹣0.09mol=0.01mol |
所以:n(CO2)= ![]() =0.02mol,
=0.02mol,
由于恰好完全反应,则第一份生成的CO2与混合物中含有的过氧化钠反应,第一份生成CO2的为0.02mol,生成的O2为:0.1mol﹣0.02mol=0.08mol,则:
2Na2O2+ | 4HCl= | =4NaCl+2H2O+ | O2↑ |
0.32mol | 0.08mol | ||
NaHCO3+ | 4HCl= | =NaCl+H2O+ | CO2↑ |
0.02mol | 0.02mol |
所以消耗的HCl的物质的量为:0.32mol+0.02mol=0.34mol,其物质的量浓度为: ![]() =3.4mol/L,
=3.4mol/L,
故选A.

【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一.
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:
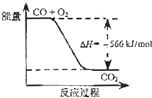
①C(s)+O2 (g)=CO2 (g)△H=﹣393.5kJmol﹣1
②CO(g)+ ![]() O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
③H2(g)+ ![]() O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 , 该反应的化学平衡常数K随温度的升高将(填“增大”、“减小”或“不变”).
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)CO2(g)+H2(g)△H<0.在甲、乙两个恒容密闭容器中,起始时按照表数据进行投料,在800℃时达到平衡状态,K=1.0.
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 .
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2 , 负极通入CO,电解质是熔融碳酸钠,写出工作时正极的电极反应式: , 若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下)L.
(4)将(2)中生成的混合气用过量的NaOH溶液吸收,得到的溶液中有一种溶质可以水解,请写出其水解的离子方程式: , .