题目内容
【题目】T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)C(s)△H<0,按照不同配比充入A,B,达到平衡时容器中A,B浓度变化如图中曲线(实线)所示,下列判断正确的是( ) 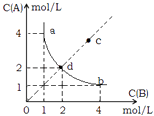
A.T°C时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T°C
D.T°C时,直线cd上的点均为平衡状态
【答案】C
【解析】解:A、平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,固体和纯液体不写入表达式,A(g)+B(g)C(s),平衡常数K= ![]() =
= ![]() =0.25,故A错误;
=0.25,故A错误;
B、依据图象分析可知,C点浓度商Q<K,反应正向进行,故B错误;
C、反应是放热反应,若C点为平衡状态,此时平衡常数小于T°C平衡常数,说明平衡逆向进行,是升温的结果,温度高于T°C,故C正确;
D、T°C时平衡常数不变,曲线上各点位平衡状态,其它点温度不同不是平衡状态,故D错误;
故选C.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.

 全程金卷系列答案
全程金卷系列答案【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一.
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:
①C(s)+O2 (g)=CO2 (g)△H=﹣393.5kJmol﹣1
②CO(g)+ ![]() O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
③H2(g)+ ![]() O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 , 该反应的化学平衡常数K随温度的升高将(填“增大”、“减小”或“不变”).
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)CO2(g)+H2(g)△H<0.在甲、乙两个恒容密闭容器中,起始时按照表数据进行投料,在800℃时达到平衡状态,K=1.0.
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 .
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2 , 负极通入CO,电解质是熔融碳酸钠,写出工作时正极的电极反应式: , 若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下)L.
(4)将(2)中生成的混合气用过量的NaOH溶液吸收,得到的溶液中有一种溶质可以水解,请写出其水解的离子方程式: , .

