题目内容
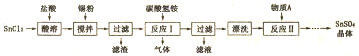
19.二氧化硫是污染大气形成酸雨的主要有害物质之一,如果了解二氧化硫的性质,它在我们的生活中也有广泛的用途.(1)下列可产生二氧化硫污染大气的是A、B、C、D.(填序号).
A.含硫矿石的冶炼 B.大量化石燃料的燃烧
C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
(2)某课外小组采集了一份雨水样品,每隔一段时间测定该雨水样品的pH变化数据如下
| 测试时间段 | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告.
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 |
| ① | 将二氧化硫通入装有品红溶液的 试管中,品红由红色变为无色 | ||
| ② | 将二氧化硫与硫化氢气体混合,出现 黄色固体. | SO2+2H2S=3S+2H2O | |
| ③ | 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
分析 (1)根据含硫化和物质的燃烧会产生二氧回答;
(2)亚硫酸是中强酸,易被氧气氧化为硫酸,硫酸属于强酸;
(3)二氧化硫具有漂白性,能使品红退色,硫元素的化合价居于中间价,既有氧化性,还具有还原性;
解答 解:(1)A.含硫矿石的冶炼过程中,含硫化合物燃烧会产生二氧化硫,故A正确;
B.大量化石燃料的燃烧会产生二氧化硫,故B正确;
C.大量烟花爆竹的燃放会产生二氧化硫,故C正确;
D.硫酸厂排放的工业尾气中含有二氧化硫,故D正确.
故答案为:A、B、C、D;
(2)雨水样品是二氧化硫溶于水形成的亚硫酸溶液,亚硫酸不稳定,易被氧气氧化为硫酸,2H2SO3+O2═2H2SO4,所以每隔一段时间测定该雨水样品的pH会减小,
故答案为:因在空气中亚硫酸与氧气反应生成酸性更强的硫酸,所以pH变小,2H2SO3+O2═2H2SO4;
(3)二氧化硫具有漂白性,能使品红退色,硫元素的化合价居于中间价,有氧化性,如果将二氧化硫通入氢硫酸溶液中,溶液中出现白色(或浅黄色)沉淀,2H2S+SO2═S↓+2H2O,还具有还原性,将二氧化硫通入装有新制氯水的试管中,则氯水由浅黄绿色变为无色,发生反应:Cl2+SO2+H2O═H2SO4+2HCl;
故答案为:
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 |
| ① | 漂白性 | 无 | |
| ② | 氧化性 | ||
| ③ | 还原性 | Cl2+SO2+H2O═H2SO4+2HCl |
点评 本题考查学生二氧化硫的性质以及滴定操作原理等方面知识,属于综合知识的考查,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列化合物中既含有离子键又含有极性共价键的是( )
| A. | MgCl2 | B. | H2O | C. | K2O2 | D. | NaOH |
4. 如图是一种形状酷似罗马两面神Janus的有机物结构简式如下,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式如下,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )
 如图是一种形状酷似罗马两面神Janus的有机物结构简式如下,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式如下,化学家建议将该分子叫做“Janusene”,有关Janusene的说法正确的是( )| A. | Janusene的分子式为C30H24 | |
| B. | Janusene属于苯的同系物 | |
| C. | Janusene苯环上的一氯代物有6种 | |
| D. | Janusene既可使酸性高锰酸钾褪色,又可与H2发生加成反应 |
8.下列各组物质混合后,不能生成NaOH的是( )
| A. | Na和H2O | B. | NaCl和H2O | ||
| C. | Na2O2和H2O | D. | Na2CO3溶液和Ca(OH)2溶液 |
9.丙烯醛的结构简式为CH2=CH-CHO,下列叙述正确的是( )
| A. | 能使溴水褪色,不能使酸性KMnO4溶液褪色 | |
| B. | 在一定条件下,与等物质的量的氢气反应生成1-丙醇 | |
| C. | 能发生银镜反应,表现出氧化性 | |
| D. | 在一定条件下,能被氧化为丙烯酸 |
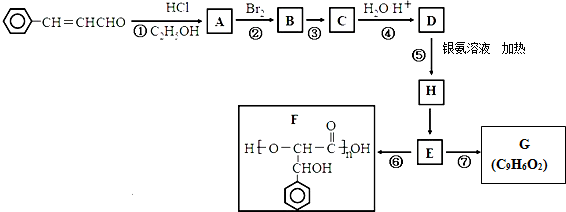
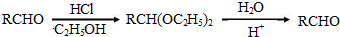
 .
. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$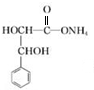 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. .(任写一种)
.(任写一种) 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了实验装置:回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了实验装置:回答下列问题: .
.


