题目内容
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
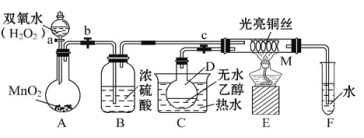
(1)B的作用:_________;C中热水的作用:__________;
(2)M处发生反应的总反应方程式为__________;
(3)从M管中可观察到的现象:______,从中可认识到该实验过程中催化剂______(填“参加”或“不参加”)化学反应。
(4)实验进行一段时间后,若撤掉酒精灯,反应仍能继续进行,则说明________。
【答案】干燥O2 使D中乙醇变为蒸气进入M参加反应(用水浴加热使乙醇气流较平稳) ![]() 受热部分的铜丝交替出现变黑、变红的现象 参加 反应放热
受热部分的铜丝交替出现变黑、变红的现象 参加 反应放热
【解析】
过氧化氢在二氧化锰催化条件下反应生成氧气,在B中用浓硫酸干燥,乙醇在水浴加热条件下挥发,与氧气在E中铜催化作用下发生氧化还原反应生成乙醛,乙醛溶于水,以此解答该题。
(1)B是吸收氧气中的水蒸气,起到干燥作用,C是加热乙醇得到乙醇蒸气进入M,且用水浴加热使乙醇气流较平稳,故答案为:干燥O2;使D中乙醇变为蒸气进入M参加反应(用水浴加热使乙醇气流较平稳);
(2)铜丝和氧气反应生成氧化铜,氧化铜和乙醇反应又生成铜,该过程总反应的方程式为:![]() ;
;
(3)乙醇的催化氧化反应中,金属铜作催化剂,真正和乙醇反应起到氧化作用的是氧化铜,实验过程中铜网出现黑色,是由于铜和氧气反应生成氧化铜,反应的方程式为:2Cu+O2![]() 2CuO,然后氧化铜与乙醇在加热条件下反应生成乙醛、铜、水,变黑的铜丝又变为红色,反应的方程式为:CH3CH2OH+CuO
2CuO,然后氧化铜与乙醇在加热条件下反应生成乙醛、铜、水,变黑的铜丝又变为红色,反应的方程式为:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O,在反应前后,实际上铜参加反应,故答案为:受热部分的铜丝交替出现变黑、变红的现象;参加;
CH3CHO+Cu+H2O,在反应前后,实际上铜参加反应,故答案为:受热部分的铜丝交替出现变黑、变红的现象;参加;
(4)撤掉酒精灯,反应仍进行,是因醇的催化氧化反应是放热反应,放出的热量满足反应所需温度,故答案为:反应放热。

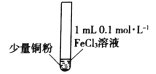
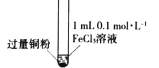
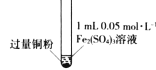
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀