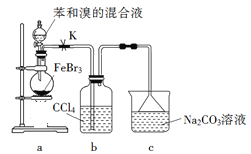
题目内容
【题目】(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+ I2(g)
(g)+ I2(g)![]()
![]() (g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。
【答案】2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= -746.5 kJ·mol-1 40% 3.56×104或3.6×104 BD 2.2 c(H+)=c(OH-)<c(SO32-)<c(HSO3-)<c(Na+)
【解析】
(1)根据燃烧热的定义写出CO燃烧的热化学方程式,再根据盖斯定律分析计算;
(2)设碘和环戊烯(![]() )的初始物质的量都为n mol,转化的物质的量为x mol,
)的初始物质的量都为n mol,转化的物质的量为x mol,![]() (g)+I2(g)=
(g)+I2(g)=![]() (g)+2HI(g)
(g)+2HI(g)
初始(mol)n n 0 0
转化(mol)xx x 2x
平衡(mol)n-x n-x x![]() 2x
2x
刚性容器内气体的压强与物质的量成正比,则: =1+20%,解得:x=0.4n mol,据此计算;达到平衡后,欲增加环戊烯的平衡转化率,需要使平衡向着正向移动,结合平衡移动原理分析;
=1+20%,解得:x=0.4n mol,据此计算;达到平衡后,欲增加环戊烯的平衡转化率,需要使平衡向着正向移动,结合平衡移动原理分析;
(3)利用溶液中存在的电荷守恒分析;
(4)吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,结合电荷守恒解答。
(1)CO燃烧热为283.0kJ·mol-l,则有2CO(g)+O2(g) =2CO2(g) ![]() H1= -566 kJ·mol-1(I),
H1= -566 kJ·mol-1(I),
N2(g)+O2(g) =2NO(g) ![]() H2=+180.5kJ·mol-1 (II),则反应I-反应II得2NO(g)+2CO(g)=N2(g)+2CO2(g),对应的
H2=+180.5kJ·mol-1 (II),则反应I-反应II得2NO(g)+2CO(g)=N2(g)+2CO2(g),对应的![]() H=
H=![]() H1-
H1-![]() H2=-566 kJ·mol-1-180.5kJ·mol-1=-746.5 kJ·mol-1,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)
H2=-566 kJ·mol-1-180.5kJ·mol-1=-746.5 kJ·mol-1,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g) ![]() H= -746.5 kJ·mol-1;
H= -746.5 kJ·mol-1;
(2)设碘和环戊烯(![]() )的初始物质的量都为n mol,转化的物质的量为x mol,
)的初始物质的量都为n mol,转化的物质的量为x mol,![]() (g)+I2(g)=
(g)+I2(g)=![]() (g)+2HI(g)
(g)+2HI(g)
初始(mol)n n 0 0
转化(mol)xx x 2x
平衡(mol)n-x n-x x 2x
刚性容器内气体的压强与物质的量成正比,则: =1+20%,解得:x=0.4n mol,解得:x=0.4n,
=1+20%,解得:x=0.4n mol,解得:x=0.4n,
平衡时环戊烯的转化率为:![]() ×100%=40%;
×100%=40%;
平衡时混合气体的压强为:105Pa×(1+20%)=1.2×105Pa,混合气体总物质的量为:(n-0.4n+n-0.4n+0.4n+0.4n×2)mol=2.4nmol,
平衡时各组分所占压强分别为p(![]() )=p(I2)=
)=p(I2)=![]() ×1.2×105Pa=3×104Pa,p(
×1.2×105Pa=3×104Pa,p(![]() )=
)=![]() ×1.2×105Pa=2×104Pa,p(HI)=
×1.2×105Pa=2×104Pa,p(HI)=![]() ×1.2×105Pa=4×104Pa,该反应的平衡常数Kp=
×1.2×105Pa=4×104Pa,该反应的平衡常数Kp=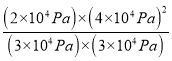 ≈3.56×104Pa(或3.6×104 Pa);
≈3.56×104Pa(或3.6×104 Pa);
A.通入惰性气体,各组分浓度不变,平衡不移动,则环戊烯的转化率不变,故A错误;
B.该反应为吸热反应,提高温度平衡向着正向移动,环戊烯的转化率增大,故B正确;
C.增加环戊烯浓度,环戊烯的转化率减小,故C错误;
D.增加碘浓度,反应物浓度增大,平衡向着正向移动,环戊烯的转化率增大,故D正确;
故答案为:40%;3.56×104;BD;
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-),中![]() =
=![]() =
=![]() +1=2.2;
+1=2.2;
(4)根据表格中的数据可知,当c(SO32-=c(HSO3-)时,溶液呈碱性,所以要使吸收液呈中性,c(HSO3-)应稍大些,此时溶质为亚硫酸钠和亚硫酸氢钠,c(Na+)最大,则离子浓度为c(H+)=c(OH-)<c(SO32-)<c(HSO3-)<c(Na+)。