��Ŀ����
����Ŀ����¯ú��Ϊ���������в����ĸ���Ʒ����Ҫ�ɷ�ΪN2��CO��CO2��H2O�ȣ����п�ȼ�ɷ�CO����Լռ25%���ң�CO2��N2�ĺ����ֱ�ռ15%��55%���ش��������⣺
��1�������ἰ����������У���������ȵ�������������д��ѧʽ����
��2����¯ú����CO���нϸߵ����ü�ֵ��������H2�ϳɼ��飬��֪�йط�Ӧ���Ȼ�ѧ����ʽ���£� ��H2��g��+ ![]() O2��g��=H2O��l����H=��285.8kJ/mol
O2��g��=H2O��l����H=��285.8kJ/mol
��CO��g��+ ![]() O2��g��=CO2��g����H=��283.0kJ/mol
O2��g��=CO2��g����H=��283.0kJ/mol
��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��890.3kJ/mol
��CO��g��+2H2��g��=CH4��g��+ ![]() O2��g����H=kJ/mol��
O2��g����H=kJ/mol��
��3����¯ú����N2�ĺ����ϸߣ�����COǰ��Ҫ��CO ���и�����ʵ��CO��N2�ķ��룮 �ٹ�ҵ�ϳ����ô�����ͭ����Һ������CO���÷�Ӧ���Ȼ�ѧ����ʽCH3COOCu��NH3��2��aq��+CO��g���TCH3COOCu��NH3��2CO��aq����H��0������CO�����Һ�����ʵ������ɻָ�Ϊ������ͭ����Һ���Ӷ�ʵ��CO������Һ�ķ��룬������̿ɲ�ȡ�Ĵ�ʩ����д��һ�ּ��ɣ���
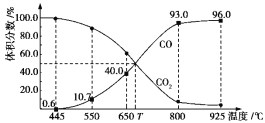
�ڵ�ĿǰΪֹ��CO�������Ŀ������������ͭΪ������ָ����ڸ��������ϣ�Ȼ����ñ�ѹ������PSA����ʽ�ں�N2��ϵ���ѳ�CO��ͼ�DZ�ѹ�������ո�¯ú����CO������ͼ��
PSA��I����CO2ʱ���PSA��II��CO�����ʵ�Ӱ�����ͼ���ɴ˿ɼ���Ϊ�˱�֤������ͭ��������CO���������ᴿҪ��Ӧ��ȡ�Ĵ�ʩ�� �� ���ſ����塱����Ҫ�ɷ�Ϊ �� 
��4����¯���������з�������Ҫ��ӦΪFe2O3��s��+3CO��g���T2Fe ��s��+3CO2��g�����÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�������ʾ��
�¶�/�� | 1000 | 1115 | 1300 |
ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
�ٸ÷�Ӧ�ġ�H0���������������=������
�������������Ӧ��CO ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
a���ʵ����ͷ�Ӧ��ϵ���¶�
b����ʱ�Ƴ���ϵ�е�CO
c��������ʵĴ���
d����С�������ݻ�
e������Fe2O3������
���𰸡�
��1��N2��CO
��2��+35.7
��3�����»��ѹ��������PSA��I�н�CO2�ѳ�����֤PSA��I����CO2��ʱ�䣩������
��4������ab
���������⣺��1��N2��CO��CO2��H2O�еĵ������ֱ�Ϊ14��14��22��10�����ʵ�����COΪ�ȵ����壬���Դ��ǣ�N2��CO����2����֪��Ӧ��H2��g��+ ![]() O2��g��=H2O��l����H=��285.8kJ/mol��CO��g��+
O2��g��=H2O��l����H=��285.8kJ/mol��CO��g��+ ![]() O2��g��=CO2��g����H=��283.0kJ/mol
O2��g��=CO2��g����H=��283.0kJ/mol
��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��890.3kJ/mol
���ݸ�˹���ɿ�֪�����١�2+�ک��ۿɵã�CO��g��+2H2��g��=CH4��g��+ ![]() O2��g����H=����285.8kJ/mol����2+����283.0kJ/mol��������890.3kJ/mol��=+35.7KJ/mol�����Դ��ǣ�+35.7����3����CH3COOCu��NH3��2 ��aq��+CO��g��CH3COOCu��NH3��2CO��aq����H��0����Ӧ�����������С�ķ��ȷ�Ӧ���������¶Ȼ��Сѹǿ������ʹƽ�����ƴӶ�ʵ��CO������Һ�ķ��룬���Դ��ǣ����»��ѹ��
O2��g����H=����285.8kJ/mol����2+����283.0kJ/mol��������890.3kJ/mol��=+35.7KJ/mol�����Դ��ǣ�+35.7����3����CH3COOCu��NH3��2 ��aq��+CO��g��CH3COOCu��NH3��2CO��aq����H��0����Ӧ�����������С�ķ��ȷ�Ӧ���������¶Ȼ��Сѹǿ������ʹƽ�����ƴӶ�ʵ��CO������Һ�ķ��룬���Դ��ǣ����»��ѹ��
��CO�������Ŀ����������ͭ��+1��Ϊ������ָ����ڸ��������ϣ�Ȼ����ñ�ѹ������PSA����ʽ�ں�N2��ϵ���ѳ�CO��ͼ�����֪ʱ��Խ��CO������Խ�ߣ�Ϊ�˱�֤��ͭ��������CO���������ᴿҪ��Ӧ��ȡ�Ĵ�ʩ�Ǿ�����PSA��I�н�CO2 �ѳ�����֤PSA��I����CO2��ʱ�䣩�����ſ����塱����Ҫ�ɷ�Ϊ������
���Դ��ǣ�������PSA��I�н�CO2 �ѳ�����֤PSA��I����CO2��ʱ�䣩����������4�����¶�Խ�ߣ��÷�Ӧ��ƽ�ⳣ��ԽС���������¶ȣ�ƽ�����ƣ���Ӧ���ȣ�����HС��0�����Դ��ǣ�����
��a���ʵ����ͷ�Ӧ��ϵ���¶ȣ�ƽ�����ƣ���CO��ƽ��ת������ߣ���a��ȷ��
b����ʱ�Ƴ���ϵ�е�CO2 �� ƽ�����ƣ���CO��ƽ��ת������ߣ���b��ȷ��
c��������ʵĴ�����ƽ�ⲻ�ƶ���CO��ƽ��ת���ʲ��䣬��c����
d�����ڴ˷�Ӧ�Ǹ���������ʵ�������ķ�Ӧ���ʼ�С�������ݻ���ƽ�ⲻ�ƶ���CO��ƽ��ת���ʲ��䣬��d����
e������������Ϊ���壬������Fe2O3������ƽ�ⲻ�ƶ�����CO��ƽ��ת���ʲ��䣬��e����
��ѡab��
�����㾫�������÷�Ӧ�Ⱥ��ʱ�ͻ�ѧƽ��״̬���ʼ���������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ���ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����