题目内容
【题目】在0.1molL﹣1 NH3H2O溶液中存在如下电离平衡:NH3H2ONH4++OH﹣ . 对于该平衡,下列叙述中正确的是( )
A.加入水时,溶液中 ![]() 增大
增大
B.降低温度,溶液中c(NH4+)增大
C.加入少量NaOH固体,平衡向左移动,电离平衡常数减小
D.加入少量0.1 mol?L﹣1 盐酸,溶液中c(OH﹣)增大
【答案】A
【解析】解:A.加水稀释时,促进一水合氨电离,氢氧根 离子的物质的量增大,一水合氨的物质的量减小,所以溶液中 ![]() 增大,故A正确;
增大,故A正确;
B.一水合氨的电离是吸热反应,降低温度抑制其电离,则溶液中c(NH4+)减小,故B错误;
C.向氨水中加入少量氢氧化钠,溶液中氢氧根离子浓度增大,则抑制一水合氨电离,温度不变,电离平衡常数不变,故C错误;
D.向氨水中加入少量盐酸,氢离子和氢氧根离子反应生成水,所以溶液中c(OH﹣)减小,故D错误;
故选A.
【考点精析】通过灵活运用弱电解质在水溶液中的电离平衡,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理即可以解答此题.

【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%.回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是(写化学式).
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下: ①H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8kJ/mol
O2(g)=H2O(l)△H=﹣285.8kJ/mol
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJ/mol
O2(g)=CO2(g)△H=﹣283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+ ![]() O2(g)△H=kJ/mol.
O2(g)△H=kJ/mol.
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离. ①工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式CH3COOCu(NH3)2(aq)+CO(g)═CH3COOCu(NH3)2CO(aq)△H<0.吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有(写出一种即可).
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO.图是变压吸附回收高炉煤气中CO的流程图: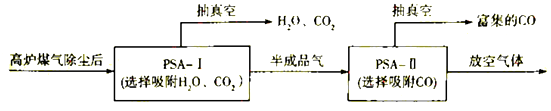
PSA﹣I吸附CO2时间对PSA﹣II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是 , “放空气体”的主要成分为 . 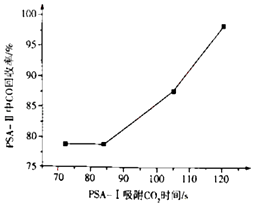
(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)═2Fe (s)+3CO2(g).该反应在不同温度下的平衡常数如表所示:
温度/℃ | 1000 | 1115 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
①该反应的△H0(填“>”“<”或“=”).
②欲提高上述反应中CO 的转化率,可采取的措施是 .
a.适当降低反应体系的温度
b.及时移出体系中的CO
c.加入合适的催化剂
d.减小容器的容积
e.增大Fe2O3的量.
【题目】一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)COCl2(g),其中容器I中5min时到达平衡.下列说法中正确的是( )
温度/℃ | 起始物成质的量/mol | 平衡物质的两/mol | |||
容器编马 | CO | Cl2 | COCl2 | COCl2 | |
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 07 |
A.容器I中前5min的平均反应速率v(CO)=0.16molL﹣1min﹣1
B.该反应正反应为吸热反应
C.容器Ⅱ中起始时Cl2的物质的量为0.55mol
D.若起始时向容器I加入CO0.8mol,Cl20.8mol,达到平衡时CO转化率大于80%.