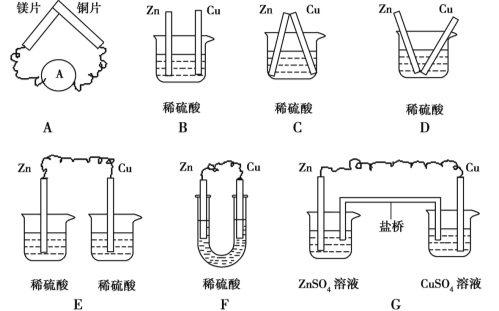
题目内容
【题目】燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g)△H=﹣394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( ) 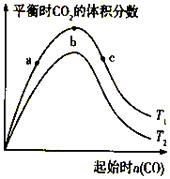
A.T1比T2高
B.b点SO2转化率最高
C.b点后曲线下降是因CO体积分数升高
D.减小压强可提高CO,SO2转化率
【答案】C
【解析】解:A、CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g)△H=﹣394.0kJ/mol,正反应是放热反应,温度越高二氧化碳的含量越少,所以由图可知T1比T2低,故A错误;B、增加一种反应物本身的转化率降低,但另一种物质的转化率升高,所以b点二氧化硫的转化率最低,而c点二氧化硫的转化率最高,故B错误;
C、一氧化碳的物质的量增加,导致一氧化碳体积分数变大,二氧化碳的体积分数减小,所以b点后曲线下降是因CO体积分数升高,故C正确;
D、CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g)正反应是气体体积缩小的反应,所以增大压强,平衡正向移动,则减小压强可降低CO、SO2转化率,故D错误;
故选C.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.

【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%.回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是(写化学式).
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下: ①H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8kJ/mol
O2(g)=H2O(l)△H=﹣285.8kJ/mol
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJ/mol
O2(g)=CO2(g)△H=﹣283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+ ![]() O2(g)△H=kJ/mol.
O2(g)△H=kJ/mol.
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离. ①工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式CH3COOCu(NH3)2(aq)+CO(g)═CH3COOCu(NH3)2CO(aq)△H<0.吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有(写出一种即可).
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO.图是变压吸附回收高炉煤气中CO的流程图: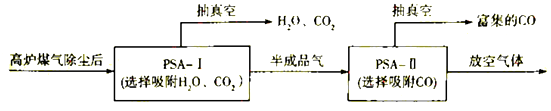
PSA﹣I吸附CO2时间对PSA﹣II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是 , “放空气体”的主要成分为 . 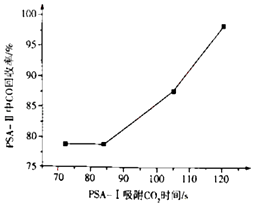
(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)═2Fe (s)+3CO2(g).该反应在不同温度下的平衡常数如表所示:
温度/℃ | 1000 | 1115 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
①该反应的△H0(填“>”“<”或“=”).
②欲提高上述反应中CO 的转化率,可采取的措施是 .
a.适当降低反应体系的温度
b.及时移出体系中的CO
c.加入合适的催化剂
d.减小容器的容积
e.增大Fe2O3的量.