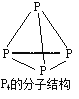
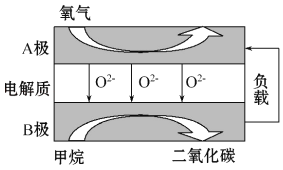
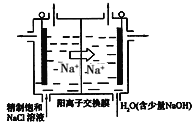
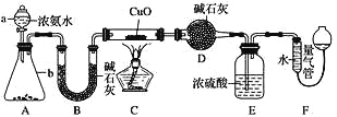
题目内容
【题目】将1.92 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到1.12 L标准状况下的气体(假设只有NO2、NO),则反应消耗的硝酸的物质的量可能是
A.0.11 molB.0.1 molC.0.09 molD.0.08 mol
【答案】A
【解析】
1.92 g铜的物质的量是n(Cu)=![]() =0.03 mol,标准状况下的1.12 L气体NO2、NO的物质的量n(NO+NO2)=
=0.03 mol,标准状况下的1.12 L气体NO2、NO的物质的量n(NO+NO2)=![]() =0.05 mol,在反应中HNO3的作用有二部分,分别变为Cu(NO3)2和NO、NO2,根据Cu元素守恒可知n[Cu(NO3)2]= n(Cu)=0.03 mol,根据N元素守恒可知HNO3的物质的量n(HNO3)=2n[Cu(NO3)2]+n(NO+NO2)=2×0.03 mol+0.05 mol=0.11 mol,故合理选项是A。
=0.05 mol,在反应中HNO3的作用有二部分,分别变为Cu(NO3)2和NO、NO2,根据Cu元素守恒可知n[Cu(NO3)2]= n(Cu)=0.03 mol,根据N元素守恒可知HNO3的物质的量n(HNO3)=2n[Cu(NO3)2]+n(NO+NO2)=2×0.03 mol+0.05 mol=0.11 mol,故合理选项是A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目