题目内容
【题目】铝试剂:(NH4)3C19H8(OH)3(COO)3,其商品名为阿罗明拿,可用来鉴定溶液中的铝离子。请回答下列问题:
(1)碳原子价层电子的电子排布图_______。
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是____________;氮元素的第一电离能呈现异常的原因是____。
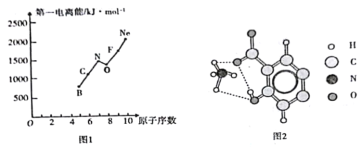
(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为_________,不同之处为_________。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为_______个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、____________、____________。
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为______________(NA表示阿伏加德罗常数的值)。
【答案】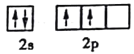 从左到右原子半径减小,元素金属性减弱,失电子能力减弱 氮原子的2p轨道为半充满状态,具有稳定性,不易失去电子 AB C 9
从左到右原子半径减小,元素金属性减弱,失电子能力减弱 氮原子的2p轨道为半充满状态,具有稳定性,不易失去电子 AB C 9 ![]() (NH4+)N-H---O(OH) (OH)O-H---O(COO-)
(NH4+)N-H---O(OH) (OH)O-H---O(COO-) ![]()
【解析】
(1)碳原子电子排布式为1s22s22p2,其价层电子的电子排布图为 。
。
(2)元素的第一电离能是气态电中性基态原子失去一个电子变为气态基态正离子时需要的最低能量。失去电子越难,第一电离能越大。同一周期元素从左到右,原子半径逐渐减小,原子核对核外电子的束缚力逐渐增强,失去电子越来越难,所以元素的第一电离能逐渐增大。但氮元素的2p轨道上有3个电子,是比较稳定的半充满结构,所以失去一个电子比较困难,所以其第一电离能比氧大。
(3)①从结构角度分析, NH4+与氨分子的中心原子N原子的价层电子对数均为4,均为sp3杂化,但NH4+是正四面体,而NH3为三角锥形,故相同之处选AB,不同之处选C。
②(NH4)3C19H8(OH)3(COO)3中有羟基和酯基,每个羟基的氧原子都和碳原子结合形成C—Oσ键,每个酯基中有2个C—Oσ键,所以1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为3+3×2=9个。苯环上的碳原子是sp2杂化,每个碳原子还剩一个p轨道上的电子形成大π键,参与形成大π键的原子数为6,参与形成大π键的电子数也为6,则阿罗明拿中苯环的大π键应表示为![]() 。
。
③从图2可以看出,氢键存在于NH4+中的H和COO-的氧原子之间,其表示式为(NH4+)N-H---O(COO-),还存在于NH4+中的H和羟基的O之间,表示式为(NH4+)N-H---O(OH),还存在于羟基中的H和COO-的氧原子之间,其表示式为(OH)O-H---O(COO-)。
(4)立方晶胞参数为a nm,所以晶胞的体积为(a×10-7)3cm3,阿罗明拿的晶体密度为d g·cm-3,所以一个晶胞的质量为(a×10-7)3dg。根据其晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则一个晶胞的质量为![]() g,所以(a×10-7)3d =
g,所以(a×10-7)3d =![]() ,y=
,y=![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案