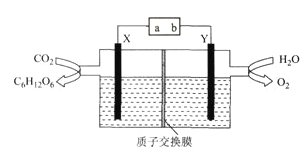
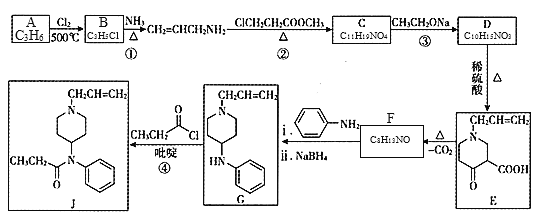
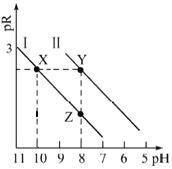
题目内容
【题目】下列说法正确的是()
A.向 AgCl 、 AgBr 的饱和溶液中滴加少量 AgNO3 溶液,溶液中![]() 不变
不变
B.向0.1mol L1 的CH3COOH 溶液中加入少量水,溶液中![]() 减小
减小
C.0.1mol K2Cr2O7 被完全还原为Cr3 时,转移的电子数约为1.806 1023
D.一定条件下,反应 2NO(g) 2CO(g) N 2(g) 2CO 2(g) 能自发进行,该反应的ΔH>0
【答案】A
【解析】
A.AgCl、AgBr饱和溶液中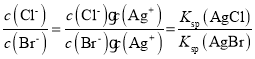 ,温度不变的情况下,该比值不变,故A正确;
,温度不变的情况下,该比值不变,故A正确;
B.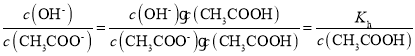 ,加水稀释CH3COOH溶液时,c(CH3COOH)减小,温度不变时,Kh不变,该比值增大,故B错误;
,加水稀释CH3COOH溶液时,c(CH3COOH)减小,温度不变时,Kh不变,该比值增大,故B错误;
C.K2Cr2O7被还原为Cr3+时,Cr元素化合价降低3价,故0.1mol K2Cr2O7被还原为Cr3+时,转移电子数约为3×0.2×6.02×1023=3.612×1023,故C错误;
D.该反应的ΔS<0,该反应能够自发进行,即ΔG=ΔH-TΔS<0,则ΔH必须小于0,故D错误;
故答案为:A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
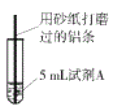
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
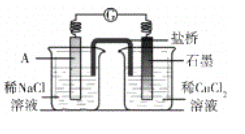
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。