题目内容
11. 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
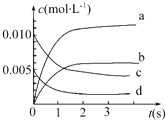
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)、铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
①工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
②工作时,电解质溶液的pH值增大(“增大”、“减小”或“不变”)
③工作时,电解质溶液中阴离子移向负极.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652kJ的热量.
①反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1.
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
③发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气.已知:
N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
肼和二氧化氮反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1.
分析 (1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,属于可逆反应,3s时反应达平衡,5s时消耗的NO为0.02mol-0.007mol=0.013mol,进而计算NO转化率;
(2)NO2是产物,随反应进行浓度增大,平衡时△c(NO2)=△c(NO);
根据v=$\frac{△c}{△t}$计算v(NO),再利用速率之比等于化学计量数之比计算v(O2);
(3)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,判断平衡的物理量随反应进行发生变化,该物理量由变化到不再变化,说明到达平衡;
(4)①正极发生还原反应,PbO2发生还原反应生成PbSO4;
②工作时,消耗硫酸,硫酸浓度减小,酸性减弱;
③工作时,电解质溶液中阴离子移向负极移动;
(5)①发生反应:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g),计算1molN2H4(l)反应放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是:产物不会造成环境污染;
③已知:Ⅰ.N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ•mol-1
Ⅱ.N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
根据盖斯定律,Ⅱ-I×$\frac{1}{2}$可得:N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g).
解答 解:(1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡,属于可逆反应,5s时消耗的NO为0.02mol-0.007mol=0.013mol,NO转化率为$\frac{0.013mol}{0.02mol}$×100%=65%,
故答案为:是;65%;
(2)NO2是产物,随反应进行浓度增大,平衡时△c(NO2)=△c(NO)=$\frac{0.02mol-0.007mol}{2L}$=0.0065mol/L,所以图中表示NO2变化的曲线是b;
2s内用NO表示的平均反应速率v(NO)=$\frac{\frac{0.02mol-0.008mol}{2L}}{2s}$=3.0×10-3mol•L-1•s-1,速率之比等于化学计量数之比,所以v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×3.0×10-3mol•L-1•s-1=1.5×10-3mol•L-1•s-1,
故答案为:b;1.5×10-3mol•L-1•s-1;
(3)a.表示同一方向反应速率,v(NO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b.随反应进行,反应混合气体总的物质的量在减小,压强减小,压强保持保持不变,说明反应到达平衡,故b正确;
c.不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(NO):v正(O2)=2:1,即v逆(NO)=2v正(O2),故c正确;
d.混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误.
故答案为:bc;
(4)①正极发生还原反应,PbO2发生还原反应生成PbSO4,正极电极反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,
故答案为:PbO2+4H++SO42-+2e-═PbSO4+2H2O;
②工作时,消耗硫酸,硫酸浓度减小,酸性减弱,电解质溶液的pH值增大,故答案为:增大;
③工作时,电解质溶液中阴离子移向负极移动,故答案为:负极;
(5)①发生反应:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g),1molN2H4(l)反应放出的热量为256.652kJ×$\frac{1mol}{0.4mol}$=641.63kJ,反应热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1;
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是:产物不会造成环境污染,
故答案为:产物不会造成环境污染;
③已知:Ⅰ.N2(g)+2O2(g)═2NO2(g),△H=+67.7kJ•mol-1
Ⅱ.N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1
根据盖斯定律,Ⅱ-I×$\frac{1}{2}$可得:N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1,
故答案为:N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1.
点评 本题考查化学平衡计算、平衡状态判断、原电池、热化学方程式等,注意对基础知识的理解掌握,难度中等.

| A. | 将8gNaOH固体溶解于1L水中 | |
| B. | 2gNaOH固体溶解在水中配成250mL溶液 | |
| C. | 将1L2mol/L的浓盐酸与9L水混合 | |
| D. | 将4.48LHCl气体溶于水配成1L溶液 |
| A. | c(H+) | B. | Ka(HF) | C. | $\frac{c({F}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+})}{c(HF)}$ |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
(1)平衡时CO2的转化率是25%.
(2)能说明反应已达平衡状态的是BC.
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(3)一定能使该反应的反应速率增大的措施有C.
A.及时分离出产物 B.适当降低温度 C.其他条件不变,增大CO2浓度.
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X可能是( )①盐酸、Na2CO3溶液
②Cl2、Fe
③CO2、Ca(OH)2溶液
④NaOH溶液、AlCl3溶液
⑤偏铝酸钠溶液、盐酸
⑥氯化钙溶液、CO2
⑦钠、氧气.
| A. | ①②③④ | B. | ①③④⑤ | C. | ③④⑤⑦ | D. | ③④⑤⑥ |
| A. | 大于7 | B. | 等于7 | C. | 小于7 | D. | 无法判断 |