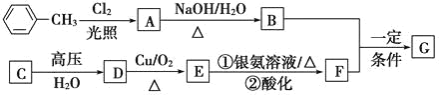
题目内容
【题目】在2L密闭容器内,t℃时发生反应:N2(g)+3H2(g)2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第4min时,N2的转化率为___;
(2)用H2表示从0~2min内该反应的平均速率v(H2)=___;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为__。(用字母填空,下同);
a.v(NH3)=0.04mol·L-1·min-1 b.v(H2)=0.03mol·L-1·min-1
c.v(N2)=0.03mol·L-1·min-1 d.v(H2)=0.00lmol·L-1·s-1
(4)平衡时容器内气体的压强与起始时比__(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比___。
(5)将amolN2与bmolH2的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(N2)=n(H2)=2n(NH3),则原混合气体中a:b=___。
(6)下列表述能作为反应达到化学平衡状态的标志是__。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成nmolN2的同时,生成3nmolH2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3molH—H键断裂的同时2molN—H键也断裂
【答案】70% 0.09mol/(L·min) c>a=d>b 变小 不变 5:7 bc
【解析】
N2的初始物质的量0.20mol,第4min时,N2的物质的量为0.06mol,根据转化率公式,转化率=![]() ×100%计算。根据平均速率v(N2)=
×100%计算。根据平均速率v(N2)=![]() ,v(H2)=3v(N2)计算。同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;根据化学反应速率与计量数的比值大小,从而确定选项,注意单位是否相同;平衡时容器内气体的压强之比等于物质的量之比,根据密度
,v(H2)=3v(N2)计算。同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;根据化学反应速率与计量数的比值大小,从而确定选项,注意单位是否相同;平衡时容器内气体的压强之比等于物质的量之比,根据密度![]() 进行判断。根据三段式进行判断。根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
进行判断。根据三段式进行判断。根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
(1)上述反应在第4min时,N2的转化率为![]() ;
;
(2)用H2表示从0~2min内该反应的平均速率,根据平均速率v(N2)= ,根据化学反应速率之比等于化学计量数之比,v(H2)=3v(N2),v(H2)=3×0.03mol/(L·min) =0.09mol/(L·min);
,根据化学反应速率之比等于化学计量数之比,v(H2)=3v(N2),v(H2)=3×0.03mol/(L·min) =0.09mol/(L·min);
(3)用各物质的化学反应速率除以化学计量数得到的数值越大,速率越快; a.![]() ;
;
b.![]() ;
;
c.v(N2)=![]() ;
;
d.v(H2)=![]() ;
;
得到该反应进行快慢的顺序为c>a=d>b;
(4) 根据化学反应,N2(g)+3H2(g)2NH3(g),假设氢气的起始物质的量为amol,
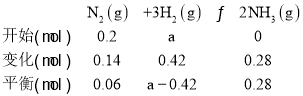
起始物质的量为(0.2+a)mol,平衡时的物质的量为(0.06+a-0.42+0.28)mol=(a-0.08) mol,(0.2+a)>(a-0.08),气体的压强与物质的量成正比,平衡时容器内气体的压强与物质的量变小;混合气体的密度![]() ,质量是不变的,容器的体积也是不变的,故混合气体的密度是不变的;
,质量是不变的,容器的体积也是不变的,故混合气体的密度是不变的;
(5)将amolN2与bmolH2的混合气体发生上述反应,
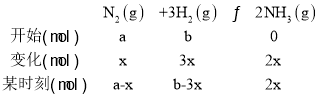
n(N2)=n(H2)=2n(NH3),即a-x=b-3x=4x,解得: a:b=5:7;
(6) a.反应速率之比等于化学计量数之比,无论是否达到平衡状态都存在反应速率v(N2):v(H2):v(NH3)=1:3:2,不能用于判断是否破坏,故a错误;
b.各组分的物质的量浓度不再改变,可说明正逆反应速率相等,达到破坏状态,故b正确;
c.混合气体的平均相对分子质量不再改变,说明气体的总物质的量不变,可说明达到破坏状态,故c正确;
d.因气体的质量不变,容器的体积不变,则无论是否达到破坏,混合气体的密度都不变,故d错误;
e.单位时间内生成nmolN2的同时,生成3nmolH2,都为逆反应,不能说明正逆反应速率相等,故e错误;
f.2v(N2)消耗=v(NH3)消耗,说明正逆反应速率相等,v(N2)消耗=2v(NH3)消耗,不能说明正逆反应速率相等,故f错误;
g.单位时间内3molHH键断裂的同时2molNH键也断裂,正逆反应速率不等,没有达到破坏状态,故g错误;
答案选

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案