题目内容
【题目】将1.0 mol/L盐酸逐滴滴入到100 mL含有NaOH、NaAlO2和Na2CO3的混合溶液中,反应过程如图所示。下列有关说法不正确的是
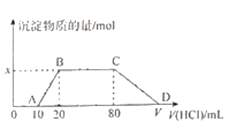
A. 混合液中NaOH的物质的量浓度为0.1 mol/L
B. x=0.01
C. BC段的反应过程离子方程式为:CO![]() +H+ ====HCO
+H+ ====HCO
D. V=110
【答案】C
【解析】
将1.0 mol/L盐酸逐滴滴入到100 mL含有NaOH、NaAlO2和Na2CO3的混合溶液中,OA段发生的反应为H++OH-=H2O,AB段开始产生沉淀,发生的反应为H++AlO2-+H2O=Al(OH)3↓,BC段无沉淀产生,发生的反应为CO32-+H+=HCO3-和H++HCO3-=H2O+CO2↑,CD段沉淀溶解,发生的反应为Al(OH)3+3H+=Al3++3H2O。
A. 混合液中NaOH的物质的量浓度为![]() ,故A正确;
,故A正确;
B. AB段消耗氢离子的物质的量为1.0mol/L×0.01L=0.01mol,根据方程式H++AlO2-+H2O=Al(OH)3↓,生成沉淀的物质的量为0.01mol,故B正确;
C. BC段的反应过程离子方程式为:CO32-+H+=HCO3-和H++HCO3-=H2O+CO2↑,故C错误;
D. 根据B已知沉淀的物质的量为0.01mol,则根据方程式Al(OH)3+3H+=Al3++3H2O,可知消耗氢离子的体积为![]() =0.03L=30mL,则V=80+30=110,故D正确。
=0.03L=30mL,则V=80+30=110,故D正确。
故答案选C。

练习册系列答案
相关题目


