��Ŀ����
����Ŀ������ı����Ϊ5.1��ƽ��������к�������Ϊ3.67��ƽ�����ռ��������������70.8 %��������һ����Ļ�ѧ��Դ���⣬������ݺ�ˮ��Դ�ۺ����ã���ش��������⣺
��1��������ˮ�ķ�����________________��дһ�ֺ����������ɣ����ɺ�ˮ��ȡ�Ĵ����к���Ca2����Mg2����SO42�������ӣ�Ϊ�˳�ȥ��Щ���ӣ���Ҫ���μ����Թ�����NaOH��BaCl2��________���ѧʽ����֮��________����������ƣ����ټ�������________�����Լ����ƣ�����������Һ����Ũ������ȴ�ᾧ���õ����Ρ�
��2������ˮMgCl2��ȡ����þ�ij��ù�ҵ������__________________��
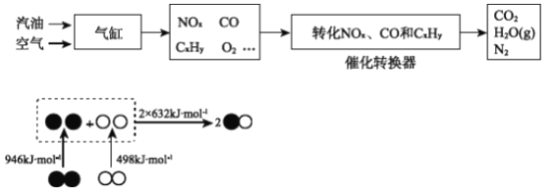
��3�����±��ͨ��Cl2�û���Br2�����ÿ��������岢��SO2���գ�ת��ΪBr����������Σ��Դﵽ�������Ŀ�ġ��ɺ�ˮ��������еķ�Ӧ�ɵó�Cl����SO2��Br����ԭ����ǿ������˳����__________��
��4����ҵ��Ҳ������Na2CO3��Һ���մ�����Br2�������廯�ƺ������ƣ�ͬʱ�ų�CO2��д����Ӧ�����ӷ���ʽ____________����H2SO4����������Һ���µõ�Br2���䷴Ӧ�����ӷ���ʽΪ_______________��
���𰸡� ���� Na2CO3 ���� ���� ��ⷨ SO2��Br����Cl�� 3CO32����3Br2��5Br����BrO3����3CO2�� 5Br����BrO3����6H����3Br2��3H2O
����������1����ˮ����ˮ��Ӧ��ˮ���η��룬�����������������ӽ������ȣ��Դ˽���Ȼ�����ȥSO42-���ӣ������е�þ���ӿ��Լ���������������ȥ����Na2CO3��Һ�ȿ��Գ�ȥ��Һ�еĸ����ӻ����Գ�ȥ��Һ�ж���ı����ӣ����˺����������Գ�ȥ������̼���ƺ��������ƣ�
��2������ˮMgCl2��ȡMg���������״̬���Ȼ�þ���Եõ�þ��������
��3�����Է����е�������ԭ��Ӧ�У���ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�
��4�����ݻ��ϼ�����������Ⱥ������غ���д�������廯�ƺ������ƣ�������Һ�лᷴӦ���з�Ӧ��
��1��Ŀǰ������ˮ�ķ����ж��֣��磺�����ᾧ��������Ĥ���ȣ�������õ��������Ȼ�����ȥSO42-���ӣ������е�þ���ӿ��Լ���������������ȥ����Na2CO3��Һ�ȿ��Գ�ȥ��Һ�еĸ����ӻ����Գ�ȥ��Һ�ж���ı����ӣ���Ҫ���μ����Թ�����NaOH��BaCl2��Na2CO3�����˺�����Һ�м����������������������ɣ���������Һ����Ũ������ȴ�ᾧ���õ����Σ�
��2������þ���ڻ��ý�������ˮ�Ȼ�þ������״̬�£�ͨ�����MgCl2![]() Mg+Cl2���õ�����þ��
Mg+Cl2���õ�����þ��
��3�����Է����е�������ԭ��Ӧ�У���ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ�Cl2+2Br-=Br2+2Cl-�л�ԭ��ΪBr-��Cl-��SO2+2H2O+Br2=H2SO4+2HBr�л�ԭ��ΪSO2��Br-�����Ի�ԭ��ǿ��˳����SO2��Br-��Cl-��
��4����ҵ��Ҳ������Na2CO3��Һ���մ�����Br2�����������廯�ƺ������Ƽ���ɫ���������̼�ų������ӷ�Ӧ����ʽΪ3CO32����3Br2��5Br����BrO3����3CO2���������廯�ƺ������ƣ��������H2SO4�����õ�Br2�������Ӻ����������������Һ�з���������ԭ��Ӧ�����嵥�ʣ���Ӧ�����ӷ���ʽΪ5Br����BrO3����6H����3Br2��3H2O��

 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�����Ŀ���л���A���������Ƿ��͵õ���Ҳ�ɴ���ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������ʵ�������ʾ��
ʵ�鲽�� | ���ͻ�ʵ����� |
��ȡA9.0g������ʹ��仯�������ܶ�����ͬ������H2��45�� | ��A����Է�������Ϊ |
����9.0gA��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g | ��A�ķ���ʽΪ |
��ȡA9.0g����������NaHCO3��ĩ��Ӧ������2.24LCO2����״�������������������Ʒ�Ӧ������2.24LH2����״���� | ���ýṹ��ʽ��ʾA�к��еĹ����� |
A�ĺ˴Ź���������ͼ�� | ������������A�Ľṹ��ʽΪ |
����֪������A��һ�������¿�������Ԫ��״����д���÷�Ӧ�Ļ�ѧ����ʽ�� �� | |
����Ŀ����0.1032molL��1 HCl��Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ��
��1��ijͬѧ�����в������ʵ�飺��ȡһ��ƿ���ô���NaOH��Һ��ϴ���Σ� ������ƿ�м��� 25��.00 mL����NaOH��Һ���ۼ��뼸��ʯ���Լ���ָʾ������ȡһ֧��ʽ�ζ��ܣ�ϴ�Ӹɾ��� ��ֱ������ʽ�ζ�����ע�������Һ�����еζ��� ������ע���ŵζ�����������ҺҺ���½���ֱ���ζ��յ㣮
�������������д�������Ϊ
��2��ȡ��25.00 mL����NaOH��ҺӦ��������ѡ����ס������ҡ���װ�ã���ȡ��NaOH��Һ��ʼƽ�Ӷ���������ʱ���Ӷ������ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰�� ![]()
��3�����ζ���ʼǰ�ζ��ܼ�������һ���ݣ��ζ�������������ʧ�� ��ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰��
��4����ƽ��ʵ�����Σ���¼���������±�
�ζ����� | ������Һ�������/mL�� | ��HCl��Һ����� | |
�ζ�ǰ������/mL�� | �ζ��������/mL�� | ||
�� | 25.00 | 1.02 | 21.04 |
�� | 25.00 | 2.00 | 22.98 |
�� | 25.00 | 0.20 | 20.18 |
�Լ������NaOH��Һ�����ʵ���Ũ�ȣ��г�������̣���