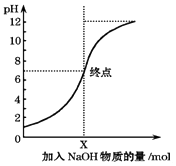
��Ŀ����
����Ŀ����0.1032molL��1 HCl��Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ��
��1��ijͬѧ�����в������ʵ�飺��ȡһ��ƿ���ô���NaOH��Һ��ϴ���Σ� ������ƿ�м��� 25��.00 mL����NaOH��Һ���ۼ��뼸��ʯ���Լ���ָʾ������ȡһ֧��ʽ�ζ��ܣ�ϴ�Ӹɾ��� ��ֱ������ʽ�ζ�����ע�������Һ�����еζ��� ������ע���ŵζ�����������ҺҺ���½���ֱ���ζ��յ㣮
�������������д�������Ϊ
��2��ȡ��25.00 mL����NaOH��ҺӦ��������ѡ����ס������ҡ���װ�ã���ȡ��NaOH��Һ��ʼƽ�Ӷ���������ʱ���Ӷ������ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰�� ![]()
��3�����ζ���ʼǰ�ζ��ܼ�������һ���ݣ��ζ�������������ʧ�� ��ᵼ����������������ҺŨ�����ƫ��ƫС�����䡰��
��4����ƽ��ʵ�����Σ���¼���������±�
�ζ����� | ������Һ�������/mL�� | ��HCl��Һ����� | |
�ζ�ǰ������/mL�� | �ζ��������/mL�� | ||
�� | 25.00 | 1.02 | 21.04 |
�� | 25.00 | 2.00 | 22.98 |
�� | 25.00 | 0.20 | 20.18 |
�Լ������NaOH��Һ�����ʵ���Ũ�ȣ��г�������̣���
���𰸡�
��1���٢ۢݢ�
��2���ң�ƫ��
��3��ƫ��
��4��c��NaOH��= ![]() =0.08256mol/L��
=0.08256mol/L��
���������⣺��1������ƿװ����Һʱ������ϴ�����Բ����ô���NaOH��Һ����ƿ���ʢٴ���
����ƿ����ʢװһ������Ĵ���Һ���ʢ���ȷ��
����ʯ����ָʾ������ɫ�����ԣ��ʢ۴���
��ȡһ֧��ʽ�ζ��ܣ�ϴ�Ӹɾ����ʢ���ȷ��
����ʽ�ζ���Ҫ�ñ�����Һ��ϴ���Σ�����ֱ������ʽ�ζ�����ע�������Һ�����еζ����ʢݴ���
������Ӧ��ע������ƿ����Һ��ɫ�仯���ʢ���
���Դ�����Т٢ۢݢޣ�
���Դ��ǣ��٢ۢݢޣ���2��������Һʢ���ڼ�ʽ�ζ����У�ͼ�м�Ϊ��ʽ�ζ��ܣ���Ϊ��ʽ�ζ��ܣ�����ʢ�������У�ȡ��NaOH��Һ��ʼƽ�Ӷ���������ʱ���Ӷ����������ƫ�ζ�ʱ���ĵı���Һ�����ƫ��������������������ҺŨ��ƫ��
���Դ��ǣ��ң�ƫ��3�����ζ���ʼǰ�ζ��ܼ�������һ���ݣ��ζ�������������ʧ�������ĵı���Һ�����ƫ����c�����⣩= ![]() ��֪����������������ҺŨ��ƫ��
��֪����������������ҺŨ��ƫ��
���Դ��ǣ�ƫ��4�����εζ���������ֱ�Ϊ20.02mL��20.98mL��19.98mL�����еڶ������ϴ�ȡ��һ���������ƽ��ֵΪ20.00mL��c��NaOH��= ![]() =0.08256mol/L��
=0.08256mol/L��
��NaOH��Һ�����ʵ���Ũ��Ϊ0.08256mol/L��
�����㾫����������Ĺؼ�������������к͵ζ������֪ʶ�������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㣮