��Ŀ����
����Ŀ��CO2����ɫ���š�����ת��������ɳ�����չ����Ҫս��֮һ��
��1��CO2��Դ֮һ������β��
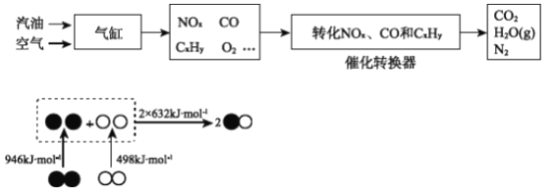

�ٸ�����ͼ��д�������ڲ���NO���Ȼ�ѧ����ʽ________��
��д��ת�������ڴ���������NOx��CO��Ӧ�Ļ�ѧ����ʽ________��
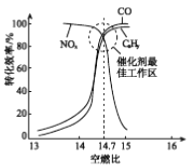
���ڴ�ת�����л�����β��ת��Ч�����ȼ�ȣ�������ȼ����������ȣ��Ĺ�ϵ����ͼ������ȼ��С��14.7���������㣬CxHy��CO���ܱ���ȫ������������ת��Ч�ʽ��ͣ�����ȼ�ȴ���14.7����NOx��ת��Ч�ʽ��ͣ�ԭ����________��
��2������NaOH��Һ���������� CO2
��֪��0.448L CO2���������״������NaOH��Һ������գ��õ�100mL����Na2CO3��NaHCO3������Һ��
��������Һ�м�������BaCl2��Һ�õ������������ˡ�ϴ�ӡ��������Ϊ1.97g��������Һ��c(Na2CO3) = ________������������NaHCO3��BaCl2����Ӧ��
�ڶԸ�����Һ�������ж���ȷ����________��
a . c (CO32- ) > c (HCO3- )
b. 2c (CO32- ) + c (HCO3- ) + c (OH- ) = c (H+ ) + c (Na+ )
c. c (H2CO3) + c (HCO3- ) + c (CO32- ) =0.2molL-1
��3����ҵ�Ͽ���CO2���Ƽ״�
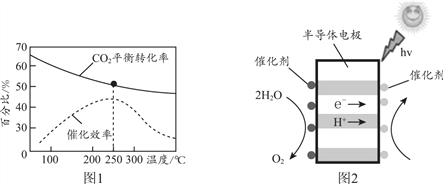
��CO2 (g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ��H < 0
CH3OH(g) + H2O(g) ��H < 0
����ͼ1������ʵ�ʹ�ҵ�����У���Ӧ�¶�ѡ��250��������________��
�����ù���ԭ������CO2��H2O�Ʊ�CH3OH��װ����ͼ2��д���Ҳ�ĵ缫��Ӧʽ________��
���𰸡� N2(g)+O2(g)====2NO(g) ��H = +180kJ��mol-1 2xCO+2NOx=======N2+2xCO2 ������������ԭ������CO��Cx Hy���Ⱥ�O2��Ӧ��ʹ��NOx�Ļ�ԭ��Ӧ���Ѽ������� 0.1mol��L-1 b c �¶ȵ���250��Cʱ��CO2��ת���ʽϴ����Ĵ�Ч�ʵͣ���Ӧ�����������¶ȸ���250��Cʱ��CO2��ת���ʺʹ�Ч�ʶ��ϵ� CO2+6e-+6H+====CH3OH+H2O
����������1�������Ȼ�ѧ��Ӧ����ʽ����д����ѧ��Ӧ����ʽ����д����Ӧ�����Ŀ��ƣ��ٶ���1molN2�л�ѧ��ʱ���յ�����Ϊ946kJ������1molO2�еĻ�ѧ�����յ�������498kJ������2molNO�л�ѧ���ų���������2��632kJ���˷�Ӧ���յ�������(946��498��2��632)kJ=180kJ�����Ȼ�ѧ��Ӧ����ʽΪ N2(g)+O2(g)=2NO(g) ��H = +180kJ��mol��1���ڸ������̣�ת������NOx��CO��Ӧ����CO2��N2����ѧ��Ӧ����ʽΪ2xCO+2NOx=N2+2xCO2 ����ת���ʽ��͵�ԭ����������������ԭ������CO��Cx Hy�����Ȼ�ԭ�������O2��Ӧ��ʹ��NOx�Ļ�ԭ��Ӧ���Ѽ������У���2�����黯ѧ���������Ũ�ȴ�С�Ƚϣ��ټ���BaCl2��Һ������BaCl2��Na2CO3=BaCO3����2NaCl��n(Na2CO3)=n(BaCO3)=1.97/197mol=0.01mol��c(Na2CO3)=0.01/(100��10��3)mol��L��1=0.1mol��L��1��������̼Ԫ���غ㣬n(NaHCO3)=(0.448/22.4��0.01)mol=0.01mol��a��Na2CO3��NaHCO3���ʵ�����ȣ���CO32��ˮ��̶ȴ���HCO3��ˮ��̶ȣ����c(HCO3��)>c(CO32��)����a����b�����ݵ���غ㣬�ó�c(Na��)��c(H��)=c(OH��)��c(HCO3��)��2c(CO32��)����b��ȷ��c�����������غ㣬 c (H2CO3) + c (HCO3�� ) + c (CO32�� ) =0.2mol��L��1����c��ȷ����3�����鷴Ӧ�����Ŀ��ơ��缫��Ӧʽ����д���ٸ���ͼ1��250��ʱ����ЧӦ��ߣ��¶ȵ���250��Cʱ��CO2��ת���ʽϴ����Ĵ�Ч�ʵͣ���Ӧ�����������¶ȸ���250��Cʱ��CO2��ת���ʺʹ�Ч�ʶ��ϵͣ��ڸ��ݵ��ӻ�H���ƶ��ķ����Լ�ԭ��صĹ���ԭ�������Ҳ�Ϊ����������Ŀ�ģ��Ҳ�缫��ӦʽCO2+6e��+6H��=CH3OH+H2O��

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д�