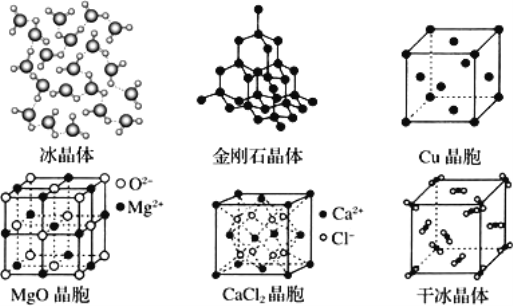
题目内容
【题目】25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图甲所示。NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图乙所示[其中a点的坐标为(9.5,0.5)]。
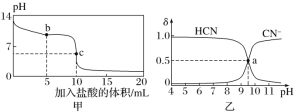
下列溶液中的关系一定正确的是( )
A.图乙中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-9.5
C.图甲中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图甲中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
【答案】A
【解析】
25℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图甲所示,可知CN-、HCN含量相等时,溶液呈碱性,说明HCN电离程度小于CN-水解程度,向10 mL 0.01 molL-1 NaCN溶液中逐滴加入0.01 molL-1的盐酸,其pH变化曲线如图乙所示,当加入盐酸5mL时,溶液组成为NaCN、HCN,溶液呈碱性,加入盐酸10mL时,完全反应生成HCN,溶液呈酸性,以此解答该题。
A. 图甲中pH=7的溶液中c(H+)=c(OH),由溶液电荷守恒可知:c(Na+)+c(H+)=c(OH)+c(CN)+c(Cl),结合物料守恒可c(Na+)=c(HCN)+c(CN)可知:c(Cl)=c(HCN),故A正确;
B. a点的坐标为(9.5,0.5),则a点c(HCN)=c(CN),NaCN的水解平衡常数K(NaCN)= =c(OH)=10-4.5mol/L,故B错误;
=c(OH)=10-4.5mol/L,故B错误;
C. b点反应生成等浓度的NaCN、HCN,溶液呈碱性,则HCN电离程度小于CN水解程度,可知c(HCN)>c(CN),故C错误;
D. 任何电解质溶液中都存在电荷守恒和物料守恒,根据物料守恒得c(Cl)=c(HCN)+c(CN),而根据电荷守恒可知,c(Na+)+c(H+)=c(Cl)+c(OH)+c(CN),则c(Na+)+c(H+)=c(HCN)+c(OH)+2c(CN),故D错误;
答案选A。

【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
| 第3周期ⅥA族 |
| 族序数是周期数的3倍 |
| 原子序数是11 |
|
|
(1)![]() 、
、![]() 的元素符号分别为______、______,
的元素符号分别为______、______,![]() 、
、![]() 的元素名称分别为______、______。
的元素名称分别为______、______。
(2)写出![]() 、
、![]() 的常见单质在加热时的反应方程式:______。
的常见单质在加热时的反应方程式:______。
(3)从原子结构的角度分析,![]() 原子与
原子与![]() 原子的______相同,
原子的______相同,![]() 原子与
原子与![]() 原子的______相同。
原子的______相同。